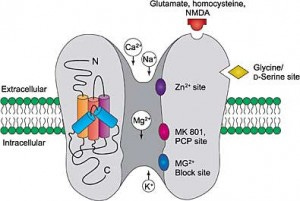
Introduction
Un des piliers dans mon bonheur d’écrire sur mon précédent blog était d’écrire sur ma façon de voir l’anesthésie générale et comment je mettais en pratique ces idées. Il y a souvent eu de chouettes discussions dans les commentaires, peut-être qu’archive.org en gardera la trace… J’espère nourrir l’esprit critique et déclencher des discussions professionnelles sur ces sujets. Enfin, je rappelle mon credo majeur : toujours avoir une idée précise en ayant une action de soin. Merci pour votre lecture.
Liste des notes de réflexion
L’équation du mouvement, publié en novembre 2010
Focus sur le paracétamol, publié en février 2011
Des diurétiques… publié en mars 2011
Ils sont forts ces belges ! (morphine : evil !) publié en janvier 2012
Réflexion sur le réveil en fin d’intervention, publié en avril 2012
Les perfusions post-opératoires, publié en octobre 2012
La kétamine, publié en janvier 2013
La clonidine, publié en février 2013
L’hydroxyzine, c’est pas ma copine, publié en mars 2013
La lidocaïne comme analgésique intraveineux, publié en juin 2013
Magnésium et anesthésie, publié en octobre 2013
Le frisson post-opératoire, publié en janvier 2014
Fibrillation auriculaire en post-opératoire, publié en février 2014
Mon ami le potassium, publié en juin 2014
Les béta-bloquants c’est pas tout le temps, publié en septembre 2014
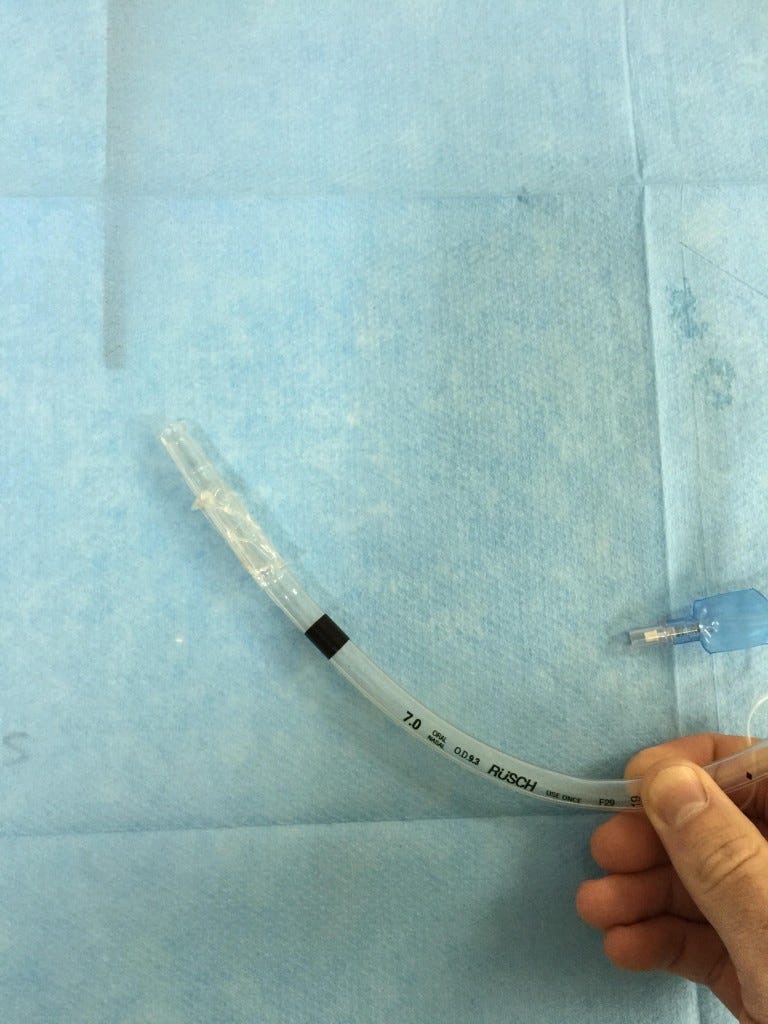
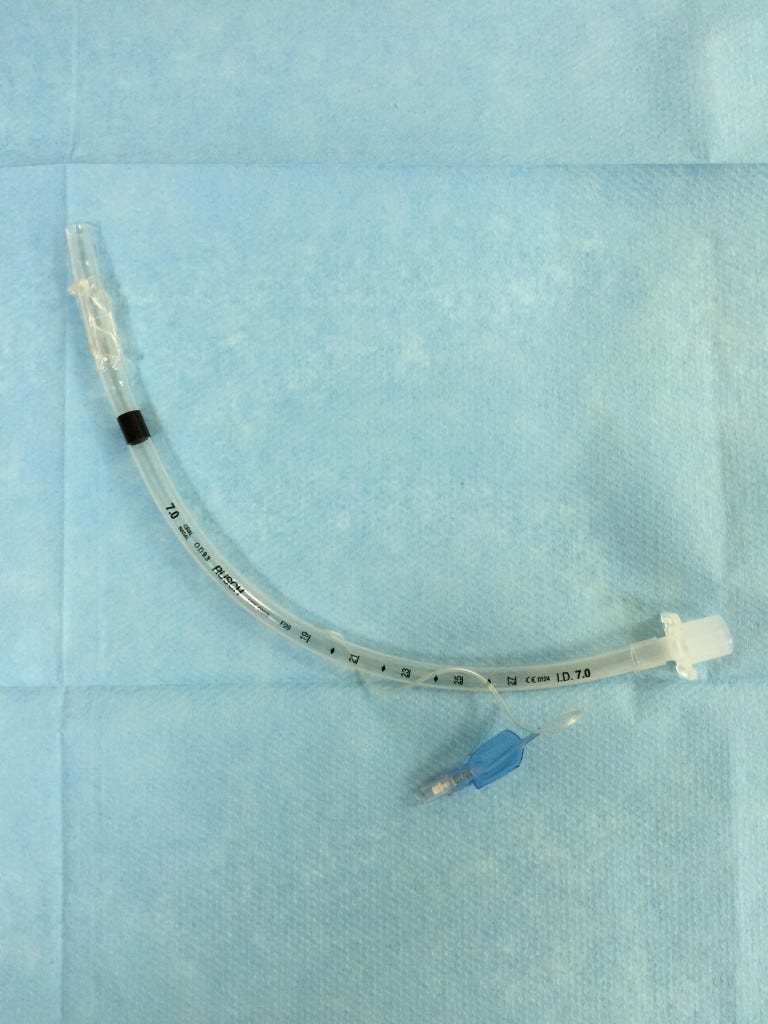
De la plicature du tuyau, publié en mai 2015
Anesthésie pour chirurgie endoscopique ORL, publié en novembre 2015
Baisse de la pression artérielle au bloc opératoire #recette #réflexes, publié en décembre 2015
Faut-il mettre une PEP au patient BPCO ? publié en mars 2016
Prévention des complications du sevrage alcoolique aka delirium tremens (DT), pratique et myth-busting publié en juin 2016
Allez y mollo sur les vitamines ! publié en septembre 2016
Comment est-ce que j’appréhende la douleur aiguë ? publié en octobre 2016
Comment je fais mon induction anesthésique en 2017 publié en mai 2017
Noradrénaline et anesthésie publié en août 2017 par Minh en tant qu’invité sur le blog
Etre prêt face à une situation à risque d’inhalation publié en mai 2019
Noradrénaline à 16 gammas, le retour publié en mai 2019
NVPO publié en 2020
Je ne prescris plus d’albumine, publié en juin 2020
L’allergie à la pénicilline publié en mai 2019 et republié ici
L'allergie à la pénicilline
Récemment, j’ai eu 5 patients à la suite en consultation avec des histoires foireuses d’allergies médicamenteuses, pour 4 d’entre eux il s’agissait de la fameuse « allergie à la pénicilline ». C’était un signe pour creuser le sujet. Ça faisait longtemps que je n’avais pas appris autant de trucs qui améliorent mes pratiques en creusant un sujet.
Je ne prescris plus d’albumine
^^ CLICK BAIT ALERT ^^
J’aime l’idée de toujours avoir une explication quand on prescrit un truc.
Je n’aime pas quand l’interne répond « c’est l’habitude ici » ou « parce que le Dr X fait ça » à ma question sur la justification de sa prescription. (Attention, une habitude de service peut être quelque chose de bien, ne me faites pas dire ce que je n’ai pas dit).
Depuis quelque temps, je lis sur l’albumine (comme soluté de remplissage). Franchement je n’ai jamais été à l’aise pour choisir entre albumine à 4% et albumine à 20%. Il y a bien sûr quelques situations « claires » en hépatologie. Mais l’hépatologie « médicale » n’est pas tellement de mon ressort. Je verse (ahaha) plutôt dans le périopératoire.
Alors pourquoi prescrire de l’albumine en péri-opératoire ? Recueil de réponses-memes :
pour mettre autre chose quand on a déjà passé plein de cristalloïdes
pour remonter l’albuminémie
parce qu’on a plus de Voluven
pour garder l’eau dans les vaisseaux
pour éponger les œdèmes vers les vaisseaux
pour mettre moins de volume de remplissage
pour boucher les trous dans le glycocalyx
pour transporter les médicaments (furosémide)
comme soluté lors d’une plasmaphérèse
https://x.com/nfkb/status/1271002168976384000
Je sais que je peux être jugé présomptueux rien que pour oser supposer des erreurs de raisonnement dans l’espace public. Franchement, je n’ai pas du tout la réponse à la question « dans quelles situations l’albumine va améliorer le pronostic de mon patient en périopératoire ? » mais je pense que prudence est mère de sureté et que lorsqu’on n’est loin de maitriser ce qu’on prescrit, il faut s’arrêter et aborder le problème différemment.
Une bonne façon d’aborder le problème c’est de lire, encore et encore et de garder un œil critique sur ce que nous faisons. Personnellement, j’achetais bien les idées sur le pouvoir oncotique, malheureusement, lorsqu’on lit sur l’équation modifiée de Starling expliquée et « popularisée » par le Dr Thomas Woodcock (voir aussi ici et là, attention c’est velu), on se rend compte que ça ne tient plus la route : les phénomènes d’absorption dans la majorité des capillaires ne sont que très transitoires.
L’albumine baisse dans l’inflammation, il y a probablement des mécanismes adaptatifs en jeu comme rendre disponible des acides aminés (pour le système immunitaire ?), pour de la régulation acido-basique ? Quand est-ce qu’on bascule dans le pathologique qui mérite l’intervention ?
Ensuite, si les colloïdes et l’albumine ont un pouvoir expansif plus élevé que les cristalloïdes, ça serait probablement en pompant de la flotte au détriment du glycocalyx, contribuant ainsi à une plus grande dilution de l’hémoglobine, pas glop.
Il y a aussi des signaux qui laissent penser que l’albumine peut-être bénéfique chez certains patients. Peut-être certains chocs septiques ? Mais aujourd’hui, je pense qu’il y a beaucoup de remplissage par albumine qui répondent juste à notre envie de *faire quelque chose* sans que ce quelque chose soit clairement positif pour le patient. Et si l’albumine permettait de sauver des vies chez des patients choc septique, j’en doute quand il s’agit d’une administration au bloc au cours d’une longue chirurgie… et le coût d’une solution d’albumine est quand même d’une cinquantaine d’euros !! (100 ml SAC 20% ou 500 ml SAD 4% c’est kif-kif chez moi en terme de prix).
En conclusion, je me vois assez bien freiner encore plus ma prescription de ces solutés dans les mois à venir. A moins que je pige (ou qu’on m’explique, cher lecteur, ne te prive pas de me donner ton avis en commentaire !) de nouveaux trucs pour améliorer le pronostic des patients.
Bonne semaine à tous !
P.S. pour équilibrer ce post voici un article récent conseillé par @rombarthelemy sur l’albumine, le glycocalyx et la microcirculation. (bon l’article est sponso par un équivalent espagnol de LFB : Grifols) https://annalsofintensivecare.springeropen.com/articles/10.1186/s13613-020-00697-1
NVPO
Ça fait longtemps que je suis attentif au sujet des nausées et vomissements post-opératoires grâce à l’encadrement dont j’ai bénéficié en tant qu’interne. Je pense que c’est un problème assez simple à cerner c’est donc dommage de le négliger.
Vous connaissez le problème, avec les douleurs c’est la principale source d’inconfort des patients après une intervention. Il y a des patients et des interventions à risque, si vous me lisez il est fort probable vous connaissiez le topo, sinon commencez par les recos SFAR
Quelques points qui méritent d’être soulignés et dont j’aimerais débattre avec vous :
1) Il faut rechercher les facteurs de risques lors de la consultation d’anesthésie et regarder les précédentes feuilles d’anesthésie quand disponibles pour documenter la présence de NVPO (et savoir monter d’un cran la prophylaxie)
2) J’utilise beaucoup plus qu’avant l’AIVOC au propofol. J’ai en tête les conséquences écologiques des gaz anesthésiques et les études qui mettent en doute leur sécurité dans la chirurgie oncologique.(Etude sur propofol et chir carcino) Plus vous utiliserez du propofol en AIVOC, mieux vous anticiperez les réveils. Sur les longues interventions, couplée au BIS/Entropie, je ne me souviens pas de difficultés pour réveiller un patient dans des délais corrects.
3) Lorsqu’il y a eu des NVPO avec une prophylaxie bien menée par le passé ou lorsque je sens les patientes très à risque (migraineuse, otologie, anxiété) je propose souvent hydroxyzine en prémédication et/ou midazolam en prémédication. Ces molécules auraient un petit bénéfice sur les NVPO. Peut être que l’usage de la prométhazine (Phenergan) ou dimenhydrinate (Mercalm) seraient plus en phase avec les (vieilles) recommandations. Les utilisez vous ?
4) Je n’ai pas accès à l’aprépitant mais il faut que je recreuse le sujet, l’utilisez vous ?
5) Je pense qu’une écrasante majorité des patients bénéficient de la dexaméthasone IV dans la procédure d’induction : prévention NVPO, effet analgésique, bénéfice anti-inflammatoire en cancérologie (?), ça serait dommage de s’en passer. Oui il peut y avoir des (petites) conséquences chez les diabétiques, mais je pense que le rapport bénéfices/risques est excellent.
6) Point qui justifie à lui seul ce billet, j’ai basculé ma prophylaxie « de base » depuis quelque temps à dexa+ondansétron. Je préfère éviter le dropéridol en première intention. Un collègue lecteur m’a fait des retours d’expériences mauvaises avec le dropéridol. La revue Prescrire trouve aussi que son profil bénéfice/risque est médiocre, voire mauvais pour les NVPO. Et personnellement, je pense que ça peut accentuer la sédation post-op (je lutte déjà contre en me bagarrant contre les prémés *systématiques) et j’ai déjà vu plusieurs cas d’akathisie. Souvent des jeunes gens opérés d’une chirurgie banale type DDS qui ne tenaient pas en place dans le secteur ambulatoire. De plus, dans mon hôpital, le dropéridol est plus cher que l’ondansétron.
7) Je ne ventile pas systématiquement les gens avant de les intuber. Quand je le fais (suspicion voies aériennes difficiles) je règle toujours la valve « APL » à 20 cmH2O. Quand un patient a présenté des difficultés de ventilation/intubation, je fais vidanger l’estomac de son air par une aspiration.
8) En post-opératoire nous utilisons avec une grande satisfaction l’ondansétron en patch sublingual (SETOFILM). Ça permet une intervention plus rapide que l’administration intra-veineuse et on peut en laisser un de secours au patient (notamment en ambulatoire)
9) Je n’ai jamais utilisé les patches de scopolamine dans la lutte contre les NVPO, le faites vous ?
10) Nous laissons boire la majorité des patients deux heures avant l’opération et j’hydrate en per-op de façon les chirurgies libérales quand il y a un risque de NVPO. Je pense que c’est mineur, mais je le fais.
Je vous conseille cette revue sur le sujet :
Noradrénaline à 16 gammas/ml, le retour !
Lors d’une garde récente, j’ai eu une discussion très intéressante avec mon collègue adoré G. La conversation portait sur l’utilisation de la noradrénaline diluée, les pour, les contres, etc. Mes commentaires a posteriori du billet original restent valables mais je tiens quand même à en reparler parce que je pense que le sujet est très important.
Depuis la publication fin 2017 du billet sur la noradrénaline diluée en anesthésie, j’en ai vraiment beaucoup fait. Avec un peu plus de recul, je peux vous apporter un peu plus d’éléments pratiques. je rappelle qu’en anesthésie-réanimation on parle souvent de « gammas » pour parler de microgrammes (µg)
Concernant les indications, je veux avoir une seringue de noradrénaline diluée dès que le patient me parait fragile avec une hémodynamique à risque de se débobiner rapidement à l’induction anesthésique. Avoir la noradrénaline diluée à portée de main n’est pas un antidote magique, il faut continuer de faire son travail de médecin anesthésiste/IADE ! Ainsi, le monitorage de la profondeur d’anesthésie me parait primordial pour titrer les drogues. Réfléchir au remplissage, à la curarisation et aux modalités de ventilation est impératif. Je précise que je travaille dans un bloc où la majorité des opérations sont courtes (ORL d’un service universitaire). Certes nous avons notre lot de longues opérations mais il ne s’agit pas de chirurgies très lourdes comme on pourrait l’entendre pour de la chirurgie vasculaire ou thoraco-viscérale.
Bref, j’utilise la noradrénline diluée majoritairement chez des patients qui arrivent stables mais pour lesquels je pressens que la vasoplégie induite par les drogues d’anesthésie puisse durer 1-4 heures tout au plus.
Concernant la posologie, l’utilisation d’un bolus (8 à 16 µg) doit être exceptionnelle (catastrophe hémodynamique imprévue genre 60/30 mmHg de pression artérielle chez un patient fragile). A l’heure actuelle, j’anticipe la dégradation hémodynamique en démarrant la seringue de noradrénaline diluée à 16 µg/ml dès le début de l’induction anesthésique. La pression artérielle se prend au brassard toutes les 2,5 minutes (quid éventuel intérêt supplémentaires de l’ischémie-reperfusion régulière ?) Je commence mon induction anesthésique avec une cible de remifentanil à 2 ng/ml de cible cérébrale et en parallèle je lance la noradrénaline diluée à 10 ml/h. Ceci à pour but de démarrer le micromoteur de la SAP qui a toujours un temps de latence comme l’a démontré l’équipe des pharmaciens du CHU de Lille avec leurs collègues anesthésistes (Dr Genay, Pr Decaudin, Pr Lebuffe). Le remifentanil est remonté d’un cran et je titre le propofol. Ensuite, selon l’évolution de la pression artérielle je suis assez simpliste, je pense que la vitesse de la SAP peut être 0 ml/h, 20 ou 40 ml/h. Quarante ml/h équivaut à 0,64 mg/h soit environ 0,15 µg/kg/min pour 70 kg. Et bien souvent on a besoin de 40 ml/h avec un BIS autour de 50. La stimulation chirurgicale permet parfois de redescendre autour de 20 ml/h soit 0,32 mg/h mais je trouve ça rare.
Concernant l’organisation au sein des blocs, c’est difficile mais il faut vraiment veiller à ce qu’il y ait une procédure claire de préparation et de stockage de la poche mère. Nous utilisons à cet effet, une poche de serum glucosé Luer-Lock qui ne peut pas être percutée pour perfusion. Cette poche est bien sûr étiquetée convenablement et ELLE RESTE au même endroit toute la journée. De plus cette poche est visuellement différente (marque différente) de nos autres solutés. Le plus difficile est la diffusion dans les équipes médicales. Au sein d’une même équipe anesthésique, les médecins peuvent être partagés quant à l’utilisation de la noradrénaline diluée. C’est parfois un casse-tête pour les infirmiers anesthésistes, je le reconnais. Mais comme pour tant d’autres choses (paramètres ventilations, habitudes d’antalgiques, de prévention des NVPO, etc.) il faut s’adapter. En tout cas j’aime l’idée de toujours pouvoir justifier chaque pratique que j’aie. Évidemment, il faut que les médecins restent prévenus du démarrage de la noradrénaline diluée et des posologies. Et je rappelle que le fait de contrer la vasodilatation induite par les drogues d’anesthésie ne reste qu’un point de la gestion hémodynamique ! Il faut garder en tête les interactions cardio-thoraciques, le transport en oxygène, les contraintes externes sur le retour veineux, etc. (un petit memo/check-list là)
Concernant le coût, une poche de serum glucosé avec 8 mg de noradrénaline coûte 1,1 euro chez nous. On fait largement la journée avec pour tous les patients (une douzaine). Pour administrer cette noradrénaline diluée, il faut 0,55 euros de seringue et prolongateur par patient. Grosso modo, j’arrive à un total TTC de 0,65 euros pour stabiliser la pression artérielle d’un patient avec la noradrénaline diluée. Une seringue d’éphédrine préremplie Aguettant coûte 3,7 euros. Si vous utilisez une seule seringue par patient le ratio de coût est x 5,7 avec l’éphédrine en seringue. Si vous utilisez deux seringues d’éphédrine le ratio de coût est x 11,4. Plus de dix fois plus cher !
Alors certes, on peut reprocher une concentration peut être aléatoire de la noradrénaline diluée vs un produit fabriqué par un laboratoire de qualité, mais la constatation pratique au bloc opératoire ne justifie pas le coût selon moi.
En 2016, nous avons consommé 1006 seringues d’éphédrine, soit 3722 euros pour 2921 interventions. Il y a donc probablement un tiers des patients qui recevaient de l’éphédrine (34,4%). Un coût moyenné de 1,27 euros par patient.
En 2018, nous avons consommé 245 combos ce qui fait 270 euros de noradrénaline diluée. En comptant les seringues et les lignes pour 1000 patients (estimation fourchette haute, la fourchette basse serait 500 patients) ça fait 820 euros. Nous avons également consommé 612 seringues d’éphédrine soit 2264 euros. Il y a eu 3119 interventions en 2018. Je trouve un coût moyenné des drogues vasoactives entre 0,90 et 0,99 euro par patient.
J’estime qu’en 2018 nous avons ainsi économisé 638 euros et je suppute que la stabilité hémodynamique des patients a été meilleure. 600 euros, ça peut paraitre un gain faible, mais sachant que les produits d’anesthésie sont peu onéreux, dans nos échelles c’est bien ! Ensuite, je pense que nous avons encore beaucoup de marge de diminution en anticipant mieux.
Un exemple, patient de 68 ans, diabète de type 2, coronaropathie, apnée du sommeil, tabagisme 70 PA qui vient pour une laryngectomie totale pour cancer. Le patient fait 95 kg et la chirurgie a duré 5 heures, c’est un peu plus long que d’habitude. (Le patient m’a donné son accord, famille présente, pour utiliser les données)
Update 2021
Etre prêt face à une situation à risque d’inhalation
J’ai eu la chance d’être formé dans des services qui ont une longue histoire de soins de patients avec des pathologies oesophagiennes et gastriques. J’ai lu avec attention le RETEX d’inhalation pour une FOGD dans la newsletter #10 de l’Anesthesia safety Network. Les patients qui ont une achalasie de l’oesophage sont probablement parmi les plus à risque d’inhalation. Il y a d’autres situations similaires comme les patients ayant eu une œsophagectomie avec gastroplastie intrathoracique, le patient souffrant d’une occlusion intestinale aigüe haute ou encore d’une épistaxis avec beaucoup de sang ingéré, l’utilisation des agonistes GLP1 dans le cadre du diabète. Bref, vous connaissez les situations.
Avec l’expérience, nous avons mis en place des stratégies complémentaires pour limiter le risque d’inhalation. Je vous propose d’y réfléchir en équipe chez vous :
Regarder l’imagerie ou en parler avec le chirurgien quant à une éventuelle dilatation gastrique ou intestinale (corollaire : se former à l’échographie pour évaluer le pylore)
discuter erythromycine, 250 mg IV en prémédication
SNG en aspiration à – 20 cmH20 avant d’arriver au bloc (attention à la distance à la narine si achalasie ou gastroplastie, plutôt 40 cm que les 60 cm habituels)
distribuer des rôles si régurgitation, nommer la personne qui bascule la table d’opération
induction plus profonde que d’habitude avec anticipation de la dégradation hémodynamique en utilisant un vasopresseur dès l’induction. J’utilise personnellement de la noradrénaline très diluée (16 gammas/ml) entre 20 et 40 ml/h (0,3 à 0,6 mg/h) pendant l’induction
certains évoquent l’idée d’intuber en premier dans l’œsophage avec une grosse sonde pour diriger le vomissement à l’extérieur de la bouche du patient, à discuter
canule d’aspiration chirurgicale (type Yankauer) en aspiration dans l’oropharynx dès la laryngoscopie, à coincer sur le côté gauche du laryngoscope
Ce même billet a été publié dans la newsletter #11 de l’ASN. Lisez les et soutenez le travail du Dr Frédéric Martin, ça vaut la peine.
Noradrénaline et anesthésie
Bonjour, je m’appelle Minh, et suis anesthésiste-réanimateur.
Rémi m’a invité ici pour discuter de la noradrénaline en anesthésie.
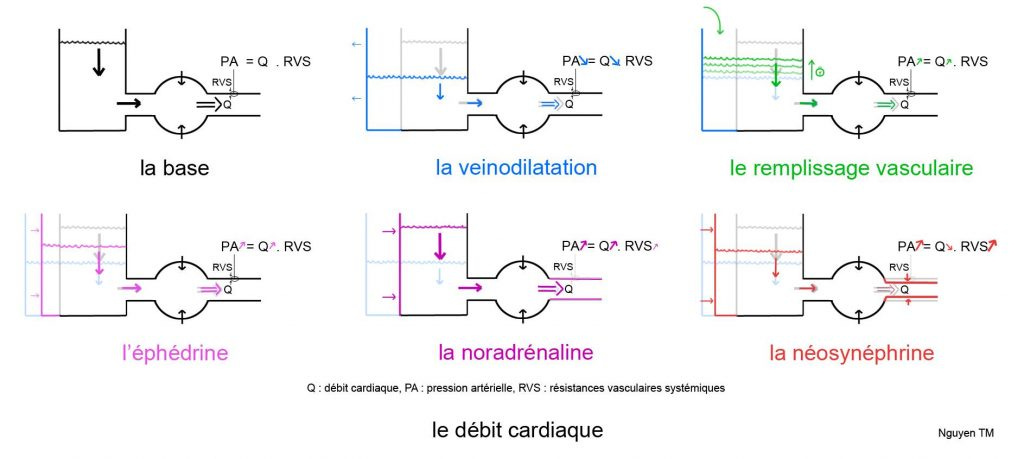
Les agents anesthésiques couramment utilisés induisent une sympatholyse, une diminution de la noradrénaline et de l’adrénaline endogènes, résultant en une veinodilatation responsable d’une baisse de la précharge, et donc du débit cardiaque. Sur nos moniteurs, nous voyons souvent une hypotension artérielle apparaître, reflet de cette baisse du débit cardiaque.
Plusieurs solutions s’offrent à nous pour restaurer ce débit cardiaque.
Nous pouvons remplir le contenu veineux. Le contenant étant plus volumineux, la restauration de la précharge sera longue par cette méthode. Il y aura donc un temps d’hypodébit cardiaque et donc d’hypoperfusion d’organe assez long.
Le bon sens nous dirait : nous avons veinodilaté, il nous suffit donc de veinoconstricter.
Veinoconstrictons. Et nous avons des produits pour ça : éphédrine (E), néosynéphrine (N), noradrénaline (NA).
L’E agit par un mécanisme majoritairement indirect, en libérant les cathécholamines endogènes au niveau des terminaisons nerveuses. Elle augmente donc la noradrénaline endogène, favorisant la veinoconstriction et l’augmentation du débit cardiaque[1; 2]. Par ailleurs, elle induit une tachycardie.
En pratique, elle fonctionne, mais son efficacité est aléatoire, et épuisable[3].
Chez un patient que l’on ne veut pas rendre tachycarde, elle peut être délétère.
La N, de part son activité alpha1, a une activité purement vasoconstrictrice : veinoconstrictrice et artérioconstrictrice. Après administration de N, la pression artérielle remonte. Nous sommes contents. Cependant, le débit cardiaque diminue. Rappelons que PA = Q * RVS, ou PA est la pression artérielle, Q le débit cardiaque, RVS les résistances vasculaires systémiques. N augmente les RVS, mais diminue le Q, car augmente la postcharge[4; 5]. Le ventricule gauche (VG) doit lutter contre une postcharge plus importante, et chez les patients aux antécédents de dysfonction VG, la N peut suraltérer la fonction VG[6].
La NA est un vasoconstricteur. Veinoconstricteur en grande partie, et aussi un peu artérioconstricteur. Une administration de NA entraine une augmentation de la précharge, très peu de la postcharge, et en résulte une augmentation du débit cardiaque[5; 6]. C’est exactement ce que nous cherchons à faire. Nous savons que les agents anesthésiques couramment utilisés induisent une sympatholyse, une diminution de la noradrénaline et de l’adrénaline endogènes, résultant en une veinodilatation responsable d’une baisse de la précharge, et donc du débit cardiaque. La NA semble être la drogue de choix.
Alors pourquoi ne l’utilisons-nous pas ? Juste personnellement, je pense qu’une non utilisation de la NA ne peut relever que d’une méconnaissance de ce médicament. J’ai souvent entendu :
“Ca fait trop de vasoconstriction, il va faire un infartcus” -> Si on dit “trop”, c’est qu’il y a un effet dose. Il faut donc diminuer les doses. Et la NA n’est pas plus artérioconstrictrice que la N.
“J’ai déjà vu des gens amputés des 4 membres car trop de NA” -> C’était probablement des chocs septiques, avec une coagulopathie septique, des microthrombi, une défaillance endothéliale, nécéssitant des fortes doses de NA pour survivre. Certes, il y a eu une nécrose des extrémités, mais réfléchissons : imaginons que cette nécrose serait dûe à la NA. Imputabilité de la NA ? Arrêtons donc la NA. Les extrémités ne deviendraient pas roses, ce serait même plutôt tout l’organisme qui serait nécrosé.
« Moi j’ai toujours fait de la néo, ça a toujours marché » -> Effectivement si la finalité est la pression artérielle (mesurée dans les gros troncs artériels), la néo marche. Mais aujourd’hui, où notre finalité est le débit cardiaque, ben ça ne marche plus…
On administre du blanc, on diminue le débit cardiaque, on hypoperfuse les organes. On trouve ça normal.
Pourquoi ne pas antagoniser notre iatrogénie ?
C’est comme si je renversais du café dans la salle de pause, et que je disais “ça va sècher” ou “l’ASH va le faire”. Vous trouvez ça normal ?
Et du coup, la NA, c’est bien, mais est-ce qu’on a du recul là-dessus ?
La réponse est oui.
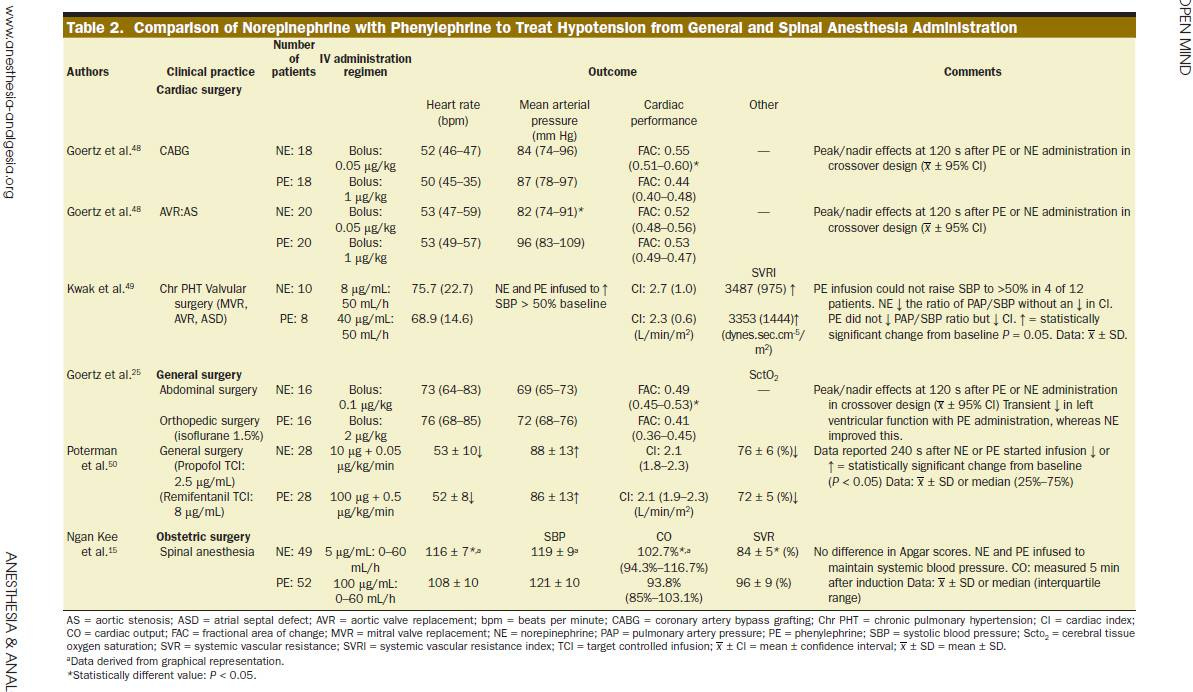
Une étude randomisée comparant la N et la NA chez des patientes bénéficiant d’une césarienne sous rachianesthésie publiée dans Anesthesiology en 2015 retrouvait : meilleur débit cardiaque dans le groupe NA, pas de différence de l’Apgar, meilleur pH néonatal dans le groupe NA, et, étonnamment, les dosages de noradrénaline et d’adrénaline dans l’artère et la veine ombilicales revenaient plus hauts dans le groupe N que dans le groupe NA. Adaptation foetale à l’hypoperfusion utéroplacentaire ?[7].
D’autres travaux comparant N et NA retrouvent une diminution du débit cardiaque dans le groupe N (voir table ci-dessous, extraite d’un article en accès libre[8]).
En pratique : voici une recette que je trouve facile et efficace :
Une ampoule de NA (8mg) dans NaCl 0,9% ou SG5% 500mL = 16µg/mL.
A l’induction, tout de suite après avoir poussé l’agent hypodynamisant : 8µg (0,5mL) à 32µg (2mL) en bolus selon fragilité prévisible du patient.
Si nécessité de répéter les boli : seringue autopulsée, environ 30mL/h, à adapter selon la cinétique du débit cardiaque ou de la pression artérielle.
Une fois après avoir essayé, on ne peut plus s’en passer.
En plus, c’est tout doux.
Ca marche au bloc, mais c’est aussi une aide précieuse en réa ou dans les étages quand on est amené à intuber dans l’urgence.
En conclusion :
L’induction anesthésique s’accompagne le plus souvent d’une diminution du débit cardiaque, dont les mécanismes font intervenir une sympatholyse, une diminution de la noradrénaline et de l’adrénaline endogènes, résultant en une veinodilatation responsable d’une baisse de la précharge, et donc du débit cardiaque.
La noradrénaline antagonise ces mêmes mécanismes et restaure efficacement le débit cardiaque.
Pour une lecture plus approfondie, je vous propose[8]:
Mets B. Should Norepinephrine, Rather than Phenylephrine, Be Considered the Primary Vasopressor in Anesthetic Practice? Anesth Analg 2016 May;122(5):1707-14.
Merci de votre attention.
Minh
UPDATE : Beau travail du Pr FUTIER http://jamanetwork.com/journals/jama/fullarticle/2654895
UPDATE par Rémi/nfkb :
L’utilisation de la noradrénaline plus précocement est intéressante comme le montre Minh içi et notre pratique tant à le prouver. Néanmoins, ce médicament très puissant reste à manier dans des environnements adaptés et penser à switcher vite vers des concentrations plus élevées et à monitorer la pression artérielle de façon invasive dès que le patient devient instable et pas juste un peu vasoplégique à cause des drogues d’anesthésie. Merci Grégoire.
Update #2 Au quotidien, nous avons protocolé son utilisation dans le service avec une dilution dans une poche (Baxter Mono-luer) qui ne se percute pour éviter l’erreur d’administrer la poche en débit libre à un patient (merci Benjamin).
Cette poche reste dans un endroit précis. De plus, j’ai plutôt tendance à faire de plus en plus de SAP. Les boli je les limite à 16 µg, quitte à les répéter (après un résultat de PNI) en attendant l’introduction de la SAP. Je me focalise sur les patients les plus âgés ou fragiles. La noradrénaline en bolus à un patient jeune, ASA 1, vierge de médicaments au long cours (anti-HTA, antidépresseurs, etc) me parait plus sujette à des réactions importantes. Autour de 30/40 ml/h, il faut réfléchir à la situation et il parait logique de préparer de la noradrénaline plus concentrée en SAP.
Deuxième billet sur la noradrénline dilué en 2019 :
Lors d’une garde récente, j’ai eu une discussion très intéressante avec mon collègue adoré G. La conversation portait sur l’utilisation de la noradrénaline diluée, les pour, les contres, etc. Mes commentaires a posteriori du billet original restent valables mais je tiens quand même à en reparler parce que je pense que le sujet est très important.
Depuis la publication fin 2017 du billet sur la noradrénaline diluée en anesthésie, j’en ai vraiment beaucoup fait. Avec un peu plus de recul, je peux vous apporter un peu plus d’éléments pratiques. je rappelle qu’en anesthésie-réanimation on parle souvent de « gammas » pour parler de microgrammes (µg)
Concernant les indications, je veux avoir une seringue de noradrénaline diluée dès que le patient me parait fragile avec une hémodynamique à risque de se débobiner rapidement à l’induction anesthésique. Avoir la noradrénaline diluée à portée de main n’est pas un antidote magique, il faut continuer de faire son travail de médecin anesthésiste/IADE ! Ainsi, le monitorage de la profondeur d’anesthésie me parait primordial pour titrer les drogues. Réfléchir au remplissage, à la curarisation et aux modalités de ventilation est impératif. Je précise que je travaille dans un bloc où la majorité des opérations sont courtes (ORL d’un service universitaire). Certes nous avons notre lot de longues opérations mais il ne s’agit pas de chirurgies très lourdes comme on pourrait l’entendre pour de la chirurgie vasculaire ou thoraco-viscérale.
Bref, j’utilise la noradrénline diluée majoritairement chez des patients qui arrivent stables mais pour lesquels je pressens que la vasoplégie induite par les drogues d’anesthésie puisse durer 1-4 heures tout au plus.
Concernant la posologie, l’utilisation d’un bolus (8 à 16 µg) doit être exceptionnelle (catastrophe hémodynamique imprévue genre 60/30 mmHg de pression artérielle chez un patient fragile). A l’heure actuelle, j’anticipe la dégradation hémodynamique en démarrant la seringue de noradrénaline diluée à 16 µg/ml dès le début de l’induction anesthésique. La pression artérielle se prend au brassard toutes les 2,5 minutes (quid éventuel intérêt supplémentaires de l’ischémie-reperfusion régulière ?) Je commence mon induction anesthésique avec une cible de remifentanil à 2 ng/ml de cible cérébrale et en parallèle je lance la noradrénaline diluée à 10 ml/h. Ceci à pour but de démarrer le micromoteur de la SAP qui a toujours un temps de latence comme l’a démontré l’équipe des pharmaciens du CHU de Lille avec leurs collègues anesthésistes (Dr Genay, Pr Decaudin, Pr Lebuffe). Le remifentanil est remonté d’un cran et je titre le propofol. Ensuite, selon l’évolution de la pression artérielle je suis assez simpliste, je pense que la vitesse de la SAP peut être 0 ml/h, 20 ou 40 ml/h. Quarante ml/h équivaut à 0,64 mg/h soit environ 0,15 µg/kg/min pour 70 kg. Et bien souvent on a besoin de 40 ml/h avec un BIS autour de 50. La stimulation chirurgicale permet parfois de redescendre autour de 20 ml/h soit 0,32 mg/h mais je trouve ça rare.
Concernant l’organisation au sein des blocs, c’est difficile mais il faut vraiment veiller à ce qu’il y ait une procédure claire de préparation et de stockage de la poche mère. Nous utilisons à cet effet, une poche de serum glucosé Luer-Lock qui ne peut pas être percutée pour perfusion. Cette poche est bien sûr étiquetée convenablement et ELLE RESTE au même endroit toute la journée. De plus cette poche est visuellement différente (marque différente) de nos autres solutés. Le plus difficile est la diffusion dans les équipes médicales. Au sein d’une même équipe anesthésique, les médecins peuvent être partagés quant à l’utilisation de la noradrénaline diluée. C’est parfois un casse-tête pour les infirmiers anesthésistes, je le reconnais. Mais comme pour tant d’autres choses (paramètres ventilations, habitudes d’antalgiques, de prévention des NVPO, etc.) il faut s’adapter. En tout cas j’aime l’idée de toujours pouvoir justifier chaque pratique que j’aie. Évidemment, il faut que les médecins restent prévenus du démarrage de la noradrénaline diluée et des posologies. Et je rappelle que le fait de contrer la vasodilatation induite par les drogues d’anesthésie ne reste qu’un point de la gestion hémodynamique ! Il faut garder en tête les interactions cardio-thoraciques, le transport en oxygène, les contraintes externes sur le retour veineux, etc. (un petit memo/check-list là)
Concernant le coût, une poche de serum glucosé avec 8 mg de noradrénaline coûte 1,1 euro chez nous. On fait largement la journée avec pour tous les patients (une douzaine). Pour administrer cette noradrénaline diluée, il faut 0,55 euros de seringue et prolongateur par patient. Grosso modo, j’arrive à un total TTC de 0,65 euros pour stabiliser la pression artérielle d’un patient avec la noradrénaline diluée. Une seringue d’éphédrine préremplie Aguettant coûte 3,7 euros. Si vous utilisez une seule seringue par patient le ratio de coût est x 5,7 avec l’éphédrine en seringue. Si vous utilisez deux seringues d’éphédrine le ratio de coût est x 11,4. Plus de dix fois plus cher !
Alors certes, on peut reprocher une concentration peut être aléatoire de la noradrénaline diluée vs un produit fabriqué par un laboratoire de qualité, mais la constatation pratique au bloc opératoire ne justifie pas le coût selon moi.
En 2016, nous avons consommé 1006 seringues d’éphédrine, soit 3722 euros pour 2921 interventions. Il y a donc probablement un tiers des patients qui recevaient de l’éphédrine (34,4%). Un coût moyenné de 1,27 euros par patient.
En 2018, nous avons consommé 245 combos ce qui fait 270 euros de noradrénaline diluée. En comptant les seringues et les lignes pour 1000 patients (estimation fourchette haute, la fourchette basse serait 500 patients) ça fait 820 euros. Nous avons également consommé 612 seringues d’éphédrine soit 2264 euros. Il y a eu 3119 interventions en 2018. Je trouve un coût moyenné des drogues vasoactives entre 0,90 et 0,99 euro par patient.
J’estime qu’en 2018 nous avons ainsi économisé 638 euros et je suppute que la stabilité hémodynamique des patients a été meilleure. 600 euros, ça peut paraitre un gain faible, mais sachant que les produits d’anesthésie sont peu onéreux, dans nos échelles c’est bien ! Ensuite, je pense que nous avons encore beaucoup de marge de diminution en anticipant mieux.
Un exemple, patient de 68 ans, diabète de type 2, coronaropathie, apnée du sommeil, tabagisme 70 PA qui vient pour une laryngectomie totale pour cancer. Le patient fait 95 kg et la chirurgie a duré 5 heures, c’est un peu plus long que d’habitude. (Le patient m’a donné son accord, famille présente, pour utiliser les données)
Update 2021
Mets B. Should Norepinephrine, Rather than Phenylephrine, Be Considered the Primary Vasopressor in Anesthetic Practice? Anesth Analg. 2016 May;122(5):1707–14.
Ngan Kee WD, Lee SWY, Ng FF, Tan PE, Khaw KS. Randomized double-blinded comparison of norepinephrine and phenylephrine for maintenance of blood pressure during spinal anesthesia for cesarean delivery. Anesthesiology. 2015 Apr;122(4):736–45.
DiNardo JA, Zvara DA. Anesthesia for Cardiac Surgery. John Wiley & Sons; 2008. 475 p.
Magder S. Phenylephrine and tangible bias. Anesth Analg. 2011 Aug;113(2):211–3.
Thiele RH, Nemergut EC, Lynch C. The clinical implications of isolated alpha(1) adrenergic stimulation. Anesth Analg. 2011 Aug;113(2):297–304.
Kanaya N, Satoh H, Seki S, Nakayama M, Namiki A. Propofol anesthesia enhances the pressor response to intravenous ephedrine. Anesth Analg. 2002 May;94(5):1207–11, table of contents.
Zaimis E. Vasopressor drugs and catecholamines. Anesthesiology. 1968 Aug;29(4):732–62.
Smith NT, Corbascio AN. The use and misuse of pressor agents. Anesthesiology. 1970 Jul;33(1):58–101.
Comment je fais mon induction anesthésique en 2017
Au fil de discussions, d’explications auprès des (e)IADE et des internes, j’ai eu envie de réécrire une note sur ce sujet. Ce billet est un article descriptif. J’aime bien cet exercice car il me permet de comparer dans le temps mes pratiques. La dernière fois que j’avais écrit sur ce sujet, je pense que j’étais beaucoup plus orienté « pharmaco » & co (ahah).
L’induction anesthésique est un moment clé. Je pense qu’il faut se l’approprier, le temps d’échange avec le patient est assez court et le contexte est stressant, c’est donc d’autant plus important d’être focalisé sur le patient. Vous pouvez avoir l’impression que des gens attendent autour de vous mais rappelez vous qu’ils ont besoin que vous ayez fini votre induction pour œuvrer. Vous ne vous ferez donc pas bousculé ! Prenez votre temps. La précipitation se ressent et elle est source d’erreur.
Je pense aussi que nous avons, nous, chefs d’orchestre de l’anesthésie-réanimation, un rôle d’exemplarité à avoir. Ça peut paraître pompeux, mais j’assume. Alors si notre comportement ne ressemble pas à celui d’un chef, je pense qu’il faut travailler à rectifier le tir.
Avant d’entrer dans une salle d’opération, j’observe. Travaillez à repérer le nombre de fois où vous entrez dans une salle d’opération et que vous ouvrez d’emblée votre gamelle. Ce nombre doit tendre vers zéro.
Je m’efforce de laisser les autres intervenants parler avec le patient et finir ce qu’ils ont à faire (ex checklist).
Puis, je me présente en utilisant mon prénom, mon nom et ma fonction : « médecin anesthésiste ».
Je demande ensuite au patient comment il se sent « ça va ? » et j’écoute et observe la réaction. C’est une première prise de pouls. Si je perçois une forte anxiété, je la reconnais et je le dis clairement : « je vous sens anxieux, que puis-je faire pour que ça aille mieux ? » (et je m’y emploie, il est important de respecter son engagement, si c’est une simple réassurance, le besoin d’aller plus vite ou autre chose : le faire !)
Je lis ensuite la feuille d’anesthésie et je me fais confirmer que la checklist est bien faite : »Michel, est-ce que les vérifications usuelles de sécurité sont faites ? », sinon c’est l’occasion d’un petit « yes set » avec le patient :
« – votre prénom est bien Eliane ? – oui – Votre nom c’est bien Patabert ? oui – vous êtes bien née en novembre ? – oui -le 1er ? -oui vous êtes bien installée -oui » etc.
Pour la pose de perfusion, j’essaye de me synchroniser instinctivement avec la personne qui pose la voie. Je me place à son opposé, j’attire le regard du patient vers moi, le plus souvent en posant une première question sérieuse, puis lorsque je vois que le cathé s’apprête à affronter la barrière cutanée, je balance brutalement une phrase portant à confusion du style « êtes vous venu à cheval ou en bateau ce matin ? ». Le succès n’est pas garanti, mais le patient sent qu’on a tout de suite fait quelque chose de spécial pour lui. Le message est : « ici, c’est pas comme ailleurs ».
Ensuite, je demande au patient si je peux diminuer la lumière pour « son endormissement ». J’attends son aval. J’ajoute souvent la boutade que c’est quand même plus facile de s’endormir dans la pénombre.
Puis, selon que je vois quelque chose d’évident (profil sportif ou mains orientant sur un métier ou feeling spécial) je pars dessus instinctivement. Sinon, je demande ce que les patients aiment bien faire pour se détendre. Si cette réponse n’a pas le succès escompté, je demande où est-ce qu’ils aimeraient être s’il ne devaient pas être au bloc parmi nous. Lorsqu’on me réponds « rien ou dormir » à la première question, je pars là dessus : « il va falloir ne rien faire mais bien le faire sans toutefois y faire trop attention, etc »
Lorsque j’ai commencé ma conversation hypnotique, je glisse un soupçon de remifentanil (cible cérébrale autour de 1 ng/ml)
Puis, je demande au patient l’autorisation de prendre son pouls.
Au démarrage à proprement parler, j’invite le patient à fermer les yeux tout de suite ou maintenant (choix illusoire). Ceux qui ne semblent pas enclins à le faire, je leur propose de fixer quelque chose en hauteur derrière eux, comme le chapeau de bloc du soignant à la tête (c’est fatiguant de regarder longtemps en l’air, essayez un peu)
Selon les jours et les patients, je suis plus au moins en pacing sur leur respiration, mais je montre toujours que j’ai vu les petits signes qu’ils font (réouverture des yeux, déglutition, etc)
Souvent les internes me disent que c’est compliqué de trouver de quoi parler avec les gens. Cette question me surprend vraiment parce que je trouve ça vraiment hyper facile. Il suffit de poser des questions et d’utiliser la réponse pour relancer. J’aime bien aussi renchérir avec un petit « ça m’intéresse ce que vous dites, expliquez moi -à quoi ça ressemble – comment vous faites -avec qui vous faites ça etc »
J’encourage beaucoup le patient : il respire toujours bien et de mieux en mieux (chirurgie sinusienne, laryngée…), il fait toujours très bien ce qu’il a faire, il est super, tout est nickel, etc. Si ce sont les derniers mots qu’il entend (avant la chirurgie !), tant mieux.
S’il y a des bruits dans la salle, je les utilise tant que faire se peut : je suggère au patient qu’il peut les écouter plutôt que ma voix, qu’il peut s’y intéresser -ou pas, qu’il peut entendre ces bruits, les gens qui travaillent autour de lui pour lui, que tout ça est normal, c’est la vie au bloc opératoire, la vie c’est le mouvement, ça bouge, ça bouge dans le bon sens, ses sens se modifient petit à petit d’ailleurs, etc.
Lorsque j’ai pu glisser les principaux messages que je voulais, je démarre l’injection du propofol (toujours couplé à quelques cc de lidocaïne) tranquillement, en titration. Seulement lorsque l’anesthésie est en place, j’injecte la ketamine et/ou la lidocaïne. J’utilise d’autant plus ces produits qu’il y a un contexte propice à une souffrance morale ou physique. Idem pour la dexaméthasone, toujours après l’anesthésie (rares cas de douleurs périnéales à l’injection de dexamethasone, rationnel = ?? si quelqu’un a une explication, proposez là ici -je n’ai pas cherché).
J’injecte aussi volontiers d’autres anti-émétiques selon le score d’Apfel. J’ai tendance à diminuer les doses de dropéridol vers 0,6 mg, surtout sur les chirurgies courtes ou les petits gabarits parce que j’ai le sentiment que ça puisse donner un peu de somnolence.
Voilà, tout ça peut relever de simple trucs et astuces, mais je vous invite à essayer ne serait-ce qu’une de ces interventions comme la baisse de la luminosité. Changez un petit quelque chose, c’est intéressant ! et proposez moi en échanges vos petites habitudes
Take Care.
Comment est-ce que j’appréhende la douleur aiguë ?
Je viens de lire cette note chez le brillant Litthérateute. Cela m’a donné envie de vous parler de ma façon d’aborder la douleur aiguë. Je suis médecin anesthésiste, la gestion de la douleur aiguë c’est vraiment une part importante de mon métier. Dans l’exercice de ce billet de blog, je me suis concentré sur ce que j’écris, dans le dialogue je ne suis pas une machine, néanmoins, j’insiste quant à l’importance du choix des mots +++
L’anticipation. Je ne vais pas réécrire toute l’anesthésie dans un billet de blog mais il y a bien des situations qui méritent qu’on anticipe la gestion de la douleur : les douloureux chroniques, les angoissés, les gens qui ont eu une mauvaise expérience précédemment. Je pense que ça commence par plusieurs points :
Bien dire au patient qu’on avait compris que la douleur est un problème pour lui
Expliquer que l’on va mettre des stratégies antalgiques pour répondre à ça
Souligner que les soignants seront là pour l’accompagner et qu’on ajustera selon son ressenti
Montrer des pistes avec des exercices d’auto-hypnose auxquels il convient de se familiariser ou s’entraîner avant.
Par contre, je suis peu enclin à prescrire beaucoup d’antalgiques en fin de bloc. Je ne suis pas fan du cocktail nefopam+morphinique+paracétamol+ketamine+anti-inflammatoire pour l’expositions à des effets indésirables qu’il déclenche.
L’évaluation. Bon, là clairement, je ne suis pas dans les clous de la Qualité. Je n’utilise à peu près jamais l’EVA. Le choix des mots, des articles, de la tournure me parait vraiment importants. De plus, je crois qu’il est intéressant de répéter la réponse du patient. Cela traduit bien que vous l’avez écouté et en le redisant votre cerveau commence déjà à chercher des solutions pour lui. Dans la salle de réveil, ça se passe comme ça :
Je commence par un bref « ça va ? » Parfois accompagné d’un geste lorsque le contact a déjà été autorisé et pris (fréquent lorsque j’ai endormi le patient).
Je demande ensuite « Etes-vous confortable ? »
Si la réponse est oui, je demande : « Puis-je faire quelque chose pour que ça soit encore un peu mieux ? »
Si la réponse est non, je demande : « Qu’est-ce qui vous embête ? la respiration ? (je travaille en ORL) Le bruit ? le chaud ? le froid ? une sensation désagréable ? »
Parfois, je me focalise un peu plus sur la douleur, dans ce cas là je demande : « Est-ce qu’il y a une douleur ? »
Si la douleur est le problème, je demande si le patient ressent le besoin qu’on lui donne des médicaments contre ça, et s’il y a des médicaments qu’il préfère. Si le patient veut qu’on lui donne des antalgiques, je réponds de suite : « Nous allons faire quelque chose pour que ça aille un peu mieux. Nous avons l’habitude de ça ici, vous allez ressentir la différence ». Si je ressens le besoin d’évaluer, je demande la comparaison avec l’épisode douloureux le plus fort qu’a déjà vécu le patient.
Le traitement. Utilisez plusieurs outils ! comportement, paroles et médicaments.
Lorsqu’il faut rapidement soulager, le choix d’un morphinique me parait important. Ensuite, lorsqu’une voie veineuse est disponible et que l’environnement est favorable il faut utiliser la voie IV plutôt que s/c ou IM ! Enfin, toujours si le contexte le permet, je pense que le fentanyl ou le sufentanil agissent plus vite que la morphine.
Des explications simples : le bon sens est parfois trompeur, mais ici il me parait être plutôt un allié. Les patients comprennent bien qu’il est « normal » de ressentir de la douleur dans la zone opératoire.
Les paroles qui aident : reconnaître et la douleur et dialoguer avec le patient pour caractériser sa douleur avec des images. On peut mettre des mots sur les sensations. « Votre douleur ressemble à quoi ? Ça vous fait penser à quoi ? Et si c’était une couleur ça serait quoi ? » L’intérêt de la réification c’est qu’on peut plus facilement demander au patient ce qu’il faudrait faire pour transformer cette douleur : changer la couleur par exemple.
Méfiance avec le sur-traitement médicamenteux ! Il me parait de ne pas confondre vitesse et précipitation dans le traitement de la douleur. Agir vite, ne veut pas dire bombarder d’antalgiques ! Il me tient à cœur de faire quelque chose, puis d’évaluer s’il y a un changement, même un petit est important. L’intervention magique permettant de passer d’une douleur aiguë intense à l’ataraxie est un mirage. Les antalgiques sont globalement très efficaces (médicaments avec le NNT les plus faibles que je connaisse) mais aussi pourvoyeurs d’effets indésirables graves ou désagréables. Pour moi, ce qui compte c’est d’arriver à un équilibre où le patient trouve sa douleur « gérable ».
J’avais un peu parlé de tout ça dans un velotaf :
Allez y mollo sur les vitamines !
Le soluté glucosé avec vitamines, éléments-traces boostés d’un surplus de zinc et de sélénium est un truc que je vois souvent dans les services de chirurgie sans que j’en comprenne le rationnel.
Les vitamines et les éléments-traces jouent d’innombrables rôles. Essayer de moduler ces nutriments en espérant appuyer sur un levier précis du métabolisme est illusoire. Les dosages sont compliqués à interpréter car les taux plasmatiques sont difficilement corrélables aux taux tissulaires.
Je n’adhère pas à cette habitude de prescription du cocktail CDZnSe car :
je suis fâché avec le concept de prescriptions par habitude
ce cocktail de vitamines et de minéraux coûte approximativement 10 euros
je ne connais pas de données scientifiques étayant la prescriptions de vitamines en post-opératoire de chirurgie usuelle
cette prescription entraîne beaucoup de manipulations pour les infirmières
Ça n’est pas recommandé à ma connaissance
Les RFE SFAR/SRLF insistent sur la prescription des vitamines et minéraux en parallèle d’une nutrition parentérale. Le chapitre 8 dédié à cette question ne recommande rien de spécial en cas d’absence de nutrition.
Les recommandations canadiennes vont dans le même sens.
Les recommandations américaines suggèrent que ça pourrait être bien en réanimation mais ne précise pas le contexte autrement que « specialized nutrition ». Hum.
Globalement, la problématique de la supplémentation en vitamines et éléments-traces n’est abordée dans les recos que lorsque le patient est grave ou recevant une nutrition parentérale. Il y a vraiment peu d’arguments d’un impact sur la morbi-mortalité chez ces patients. Chez le patient stable, hydraté en post-opératoire en attendant de manger normalement, je pense que le cocktail CDZnSe a encore moins de chances de changer quoi que ce soit à la morbi-mortalité. (Notez que le polytraumatisé, et surtout le brûlé grave sont des rares situations avec des études positives dans ce contexte.)
Ensuite, il y a la problématique de la supplémentation en thiamine (B1). Deux contexte ici : alcoolique dénutri ou état de choc. J’ai déjà abordé la question de la prévention des complications du sevrage chez l’alcoolique dans une autre note. En gros, 3 jours de B1 en IV, ça suffit, ensuite l’alimentation fournira tout ce qu’il faut. Et puis, il y a le contexte de l’état de choc, où il a été imaginé (et je l’ai volontiers fait) qu’une carence en B1 (relative) pouvait être un facteur aggravant. Un essai récent limite notre espoir sur ce sujet.
Depuis, 2-3 ans, j’observe une envolée des prescriptions de vitamine C en réanimation. J’ai cru comprendre que la vitamine C était utile à la synthèse des catécholamines. Ainsi, il est imaginé que la supplémentation en vitamine C pourrait améliorer l’hémodynamique des patients choqués. Je connais mal la littérature sur ce sujet. Néanmoins, j’ai été témoin d’une complication grave qui m’a bien refroidi sur cette thématique. Des taux plasmatiques élevés d’acide ascorbique peuvent fausser la lecture de la glycémie capillaire. J’ai été indirectement témoin d’un patient faisant une hypoglycémie grave dont le diagnostic a été retardé car la glycémie capillaire était normale. Ainsi, c’est quand même ennuyeux d’avoir un problème si grave suite à une prescription sur laquelle nous manquons de recul quant à son efficacité.
Globalement, je pense qu’en matière de nutrition artificielle, il faut rester simple. La recherche de la magic bullet est un grand classique des biais cognitifs. Il n’y a pas de truc magique en médecine. Par ailleurs, je crois que la Médecine ne se résume ni à l’application rigide de recommendations ni à la prescription par habitude. Ainsi, chacun est libre de prescrire des vitamines ou des éléments-traces à son patient. Néanmoins, avec cette note, je veux rappeler que les données scientifiques sont pauvres et qu’il existe de vrais problèmes pratiques.
Prévention des complications du sevrage alcoolique aka delirium tremens (DT), pratique et myth-busting
Je travaille dans un service qui fait beaucoup de carcinologie en ORL. De fait, je m’occupe souvent de patients qui consomment beaucoup d’alcool régulièrement. Ainsi, lors d’une hospitalisation courte pour des examens complémentaires ou autour d’une opération, ces patients sont à risque de faire des symptômes liés au sevrage alcoolique.
Tout le monde connait le tryptique hydratation-benzo-vitaminothérapie. C’est plus qu’un réflexe ou un tiroir de réponse d’examen, j’ai presque l’impression que c’est un meme car ce truc s’écrit partout et qu’on ne sait plus trop démêler l’attitude rationnelle de l’habitude.
Le plus important, ce sont les benzodiazépines. Le meilleur retour que j’ai eu auprès les patients, c’est le diazepam. Avant de le prescrire, je vérifie la fonction hépatique. Sinon, l’alternative, c’est l’oxazepam. Je ne sais pas pourquoi le mot Valium fait peur, j’en ai déjà parlé dans mon billet sur l’Atarax, mais ça fonctionne vraiment bien. Diazepam, 10 mg, 3 à 6 fois par jour per os, pendant quelques jours (3-5 ?), ça me parait bien.
L’hydratation. L’activation sympathique lorsque les manifestations de sevrages sont déjà patentes peut entraîner une déshydratation qui aggrave encore la situation. C’est cette déshydratation qu’il faut dépister voire traiter. Mais, il n’y pas lieu de parler d’hyperhydratation et encore moins d’en faire (méfiez vous de tous les trucs « hyper », c’est un principe) ! Méfiez vous des perfusions inutiles, d’autant plus que ces patients peuvent être en hyponatrémie à leur arrivée à l’hôpital.
La supplémentation en B1. Là, on rentre dans le coeur du myth busting. Nos besoins en B1 (thiamine) sont estimés à 1 – 1,5 mg par jour. La thiamine est mal absorbée per os, et encore moins chez l’alcoolique dénutri. Ainsi, en supplémentant per os, on peut rencontrer des difficultés à corriger une éventuelle carence. D’où l’utilisation fréquente de la voie parentérale (surtout avec la perf prescrite systématiquement…) à la posologie mystérieuse de 1000 mg par jour. Je ne comprends pas comment cette posologie élevée est entrée dans la pratique populaire. J’ai ouï dire qu’il y avait eu une faute de frappe dans un article ancien qui se serait propagée mais je n’ai pas réussi à vérifier ça. Selon cet article de la Revue Médicale Suisse, 300 mg par jour en IV sur 30 minutes pendant 3 jours sont suffisants pour prévenir l’encéphalopathie de Gayet-Wernicke. Nous sommes loin du gramme de B1 qui traine des jours et des jours dans le soluté de perfusion… L’organisme peut accumuler un mois de réserve de thiamine. En pratique, dans mon hôpital il y a des ampoules de B1 à 500 mg qui coûte 63 cents, et des ampoules de 100 mg qui coûte 32 cents, je prescris donc 500 mg de B1.
Les autres vitamines du groupe B et le nicotinamide (PP). Je pense sérieusement qu’il y a là une habitude très répandue de prescription, plus qu’une explication rationnelle. Certes, le terrain de l’alcoolique dénutri avancé peut entraîner de multiples carences mais il n’y a pas chez l’adulte à ma connaissance de manifestation aiguë comme peut-être aggravé le déficit en thiamine par la renutrition ou la perfusion de solutés glucosé. Je m’interroge donc quant à la supplémentation en B6, B12, PP et consorts. Toutes ces vitamines ont un coût (3,39 € le combo dans mon hôpital), leur prescription entraîne des manipulations dans les perfs et peuvent exposer à risque d’effets indésirables (neurotoxicité de grosses doses de B6, allergie avec B12 par exemple).
A propos d’habitudes, de myth-busting, etc. Les anglo-saxons ont aussi leur problème avec la thiamine. Eux, c’est pas sur la posologie que le débat se pose, c’est sur l’injection avant resucrage en cas d’hypoglycémie. Marrant de voir qu’il y a des habitudes qui ont la vie dure autour d’une « simple » vitamine. Au fait, j’avais fait cette note sur hypoglycémie et alcoolisation aiguë.
Faut-il mettre une PEP au patient BPCO ?
La ventilation spontanée normale
En ventilation spontanée, lorsque nous inspirons, nous créons une petite dépression dans notre thorax qui attire l’air de l’extérieur vers nos poumons. L’expiration est neurologiquement l’inhibition de l’inspiration. L’effort inspiratoire s’arrête et le thorax et ses poumons se rétractent “passivement” via les forces élastiques du système. À la fin de l’expiration, la pression dans les voies aériennes est nulle. À cet instant très précis, la pression dans les voies aériennes est égale à la pression atmosphérique, il n’y a pas de flux d’air entre l’extérieur et les poumons. À ce moment, le volume dans les poumons est appelé la capacité résiduelle fonctionnelle (CRF)
La PEP
La PEP est une pression positive (résiduelle) à la fin de l’expiration dans les voies aériennes du patient.
Dans la majorité des cas, on emploie le terme PEP en signifiant une pression appliquée par une machine sur les voies aériennes du patient. Le patient peut-être réveillé et en ventilation spontanée avec un masque appliqué sur ses voies aériennes ou carrément sédaté, curarisé, placé sous ventilation mécanique via une intubation trachéale.
Lorsqu’une PEP est appliquée au patient, sa CRF est augmentée car des alvéoles restent remplies du fait de l’existence d’une pression s’opposant à leur vidange. Ce volume résiduel est utile pour conserver les alvéoles au-dessus de ce qu’on appelle le volume de fermeture. Le volume de fermeture est le volume critique en deça duquel, l’alvéole se collabe. Lorsque de nombreuses alvéoles se collabent, il y a formation d’atélectasies. Il existe alors des zones de poumons qui ne sont plus ventilées alors qu’elles restent perfusées, créant ainsi du shunt.
La PEP vise à éviter le collapsus alvéolaire et ne sert pas “à réouvrir” des alvéoles collabées.
La PEP réglée sur les machines est aussi appelée PEPe pour PEP extrinsèque, c’est-à-dire venant de l’extérieur du patient.
Dans certaines pathologies comme la BPCO, il peut exister une PEPi pour PEP intrinsèque. La PEPi est parfois appelée auto-PEP. Chez le sujet sain, il n’y a pas de PEPi. L’hyperinflation dynamique est une grande cause de génération d’une PEPi en pathologie.
La PEP totale est la pression positive (résiduelle) à la fin de l’expiration dans les voies aériennes du patient. Elle correspond à l’ensemble des effets de la PEPi et de la PEPe.
La BPCO
Je vous copie-colle la définition de Wikipédia : la BPCO est caractérisée par une obstruction lente et progressive des voies aériennes et des poumons, associée à une distension permanente des alvéoles pulmonaires avec destruction des parois alvéolaires. La BPCO est caractérisée par la diminution non complètement réversible des débits expiratoires.
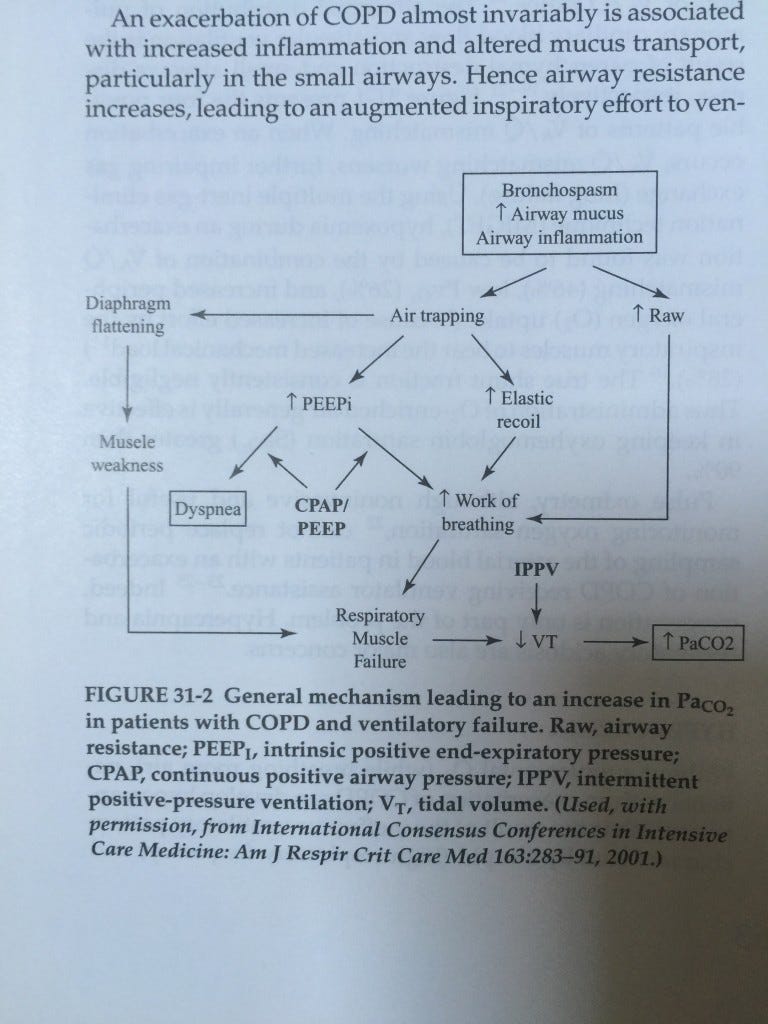
L’hyperinflation dynamique
En cas de BPCO (a fortiori si exacerbation), l’inflammation chronique réduit le diamètre des bronches. L’air rentre de façon actif grâce à la force musculaire en ventilation spontanée, ou du fait d’une pression positive en ventilation artificielle, mais les alvéoles ne se vident pas bien, car l’expiration passive ne suffit pas à pousser tout le gaz alvéolaire dehors. Il existe une diminution du débit expiratoire.
Il y a trois grands facteurs qui jouent sur l’hyperinflation dynamique : le volume courant (Vt), l’augmentation du produit (résistance * compliance) appelé constante de temps ϑ et le temps expiratoire (Te).
Le Vt : plus il y a d’air qui rentre dans le poumon, plus y a un risque qu’il n’arrive pas à sortir à cause de la diminution du débit expiratoire
ϑ = résistance * compliance. Lorsque les résistances sont élevées, c’est plus compliqué pour l’air de franchir l’obstacle dans le sens intérieur -> extérieur. Et une compliance élevée traduit un poumon qui se laisse distendre facilement, mais qui n’aura pas beaucoup de force pour se rétracter. L’élastance, la capacité de se rétracter, est l’inverse de la compliance.
Le Te : si le temps expiratoire est court, les alvéoles n’ont pas le temps de se vider.
L’hyperinflation dynamique, c’est le fait que de l’air reste piégé dans les alvéoles au fil des cycles respiratoires. Cet air dans les alvéoles génère une pression positive en fin d’expiration : c’est la PEP intrinsèque.
Les conséquences de l’hyperinflation dynamique
Lorsqu’il y a de l’hyperinflation dynamique, le volume résiduel augmente et les muscles respiratoires sont anormalement étirés. Dans cette configuration, leur fonctionnement est moins bon.
Par ailleurs, le thorax est lui aussi sous tension, ses forces de rétractions élastiques sont plus fortes et l’inspiration devra vaincre cette force supplémentaire.
Enfin, l’inspiration démarrera sur une portion moins favorable de la courbe pression-volume. En effet, lorsqu’il existe un volume résiduel, la compliance du poumon est moins bonne (il faut une plus grande différence de pression pour générer une variation de volume) et donc là encore, il faut faire un effort inspiratoire plus grand.
Au total, les muscles sont dans une mauvaise posture pour travailler et ils doivent fournir un plus grand effort pour faire rentrer l’air dans les poumons. C’est ce qu’on appelle l’augmentation du travail respiratoire.
Retenez (de façon caricatural) que si les passagers d’une rame de métro ne peuvent pas descendre parce que les portes ne s’ouvrent pas normalement, il va d’autant plus être compliqué de faire rentrer des nouveaux passagers pourtant très motivés !
La PEPi peut également avoir des conséquences hémodynamiques. L’augmentation de la pression intrathoracique peut gêner le retour veineux et diminuer le débit cardiaque.
Il existe également des difficultés en ventilation artificielle à type d’asynchronies et de difficultés pour déclencher des cycles respiratoires.
Rechercher la PEPi
Chez un patient en ventilation spontanée, c’est difficile.
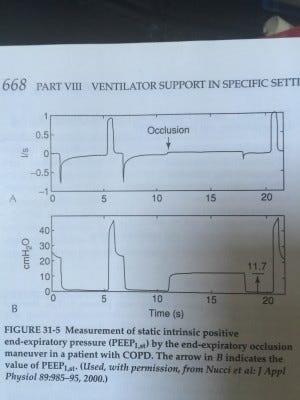
Dès lors que le patient a un support ventilatoire, il faut observer la courbe de débit expiratoire. Si le débit ne rejoint pas la ligne de base ; autrement dit si l’expiration est coupée par une nouvelle inspiration, il faut suspecter la création d’une PEPi.
Chez un patient profondément sédaté, la réalisation d’un plateau expiratoire peut déceler la PEPi.
Prise en charge classique de ces patients avec une limitation du débit expiratoire
Administration de bronchodilatateur (béta-mimétique). Les modalités d’aérosolisation sont très importantes et sortent du cadre de ce billet. Néanmoins, je pense que le spray de ventoline dans la sonde d’intubation est une vaste blague (la molécule ne peut pas progresser comme ça jusqu’aux bronches).
Je viens d’une école où les atropiniques sont regardés de travers donc je n’en prescris pas.
Corticothérapie intraveineuse.
En ventilation mécanique type VAC : fréquence basse, ratio I/E =< ⅓, Vt à 6 ml/kg avec une hypercapnie permissive. Réglages des alarmes ad hoc (Pcrête forcément élevée et toujours faire attention au plateau =< 30cmH2O)
Traitement d’un facteur déclenchant (infection par exemple)
N.B. j’ai observé dans ma pratique beaucoup de complications digestives à type de syndrome subocclusif. Je pense que c’est quelque chose qu’il faut surveiller et anticiper (nutrition, laxatifs, diminution des morphiniques, etc.)
Anecdote sur un sujet connexe.
J’ai eu à prendre en charge un patient polypathologique avec une sténose trachéale en détresse respiratoire. Il s’est révélé difficile à ventiler et à intuber. Juste après l’intubation, bradycardie extrême et catastrophe hémodynamique.
J’ai immédiatement débranché le ventilateur de la sonde d’intubation et j’ai appuyé plusieurs fois sur le thorax du patient vigoureusement.
L’hémodynamique s’est immédiatement améliorée.
Nous avions fait rentrer plein d’air dans son thorax qu’il n’avait pas pu expirer. Je pense qu’il y avait une sorte de tamponnade gazeuse. (Je lutte tous les jours contre les excès de la ventilation au masque trop vigoureuse/rapide…)
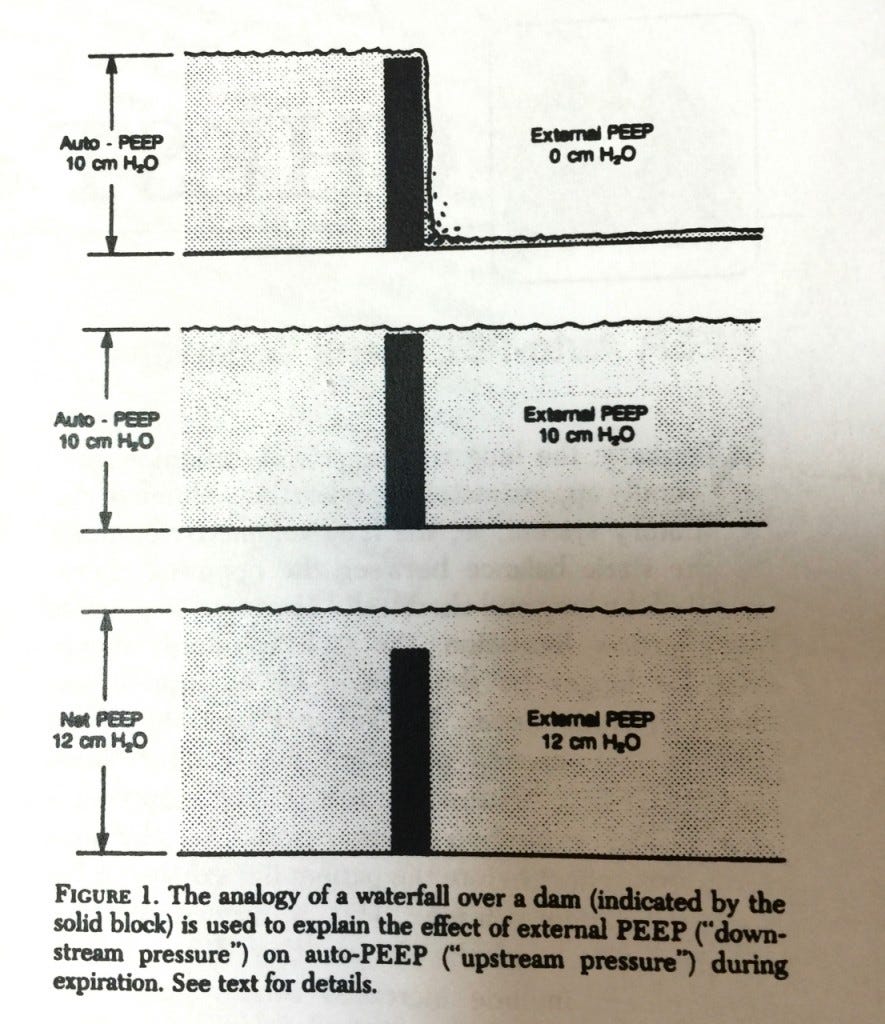
L’analogie de la cascade (waterfall model)
L’analogie de la cascade est un modèle monocompartimental proposé par un grand pneumologue américain nommé Tobin. Le débit expiratoire est assimilé au débit d’une cascade. Le débit dépend de la pression du lac d’amont et pas de celui du lac d’aval. Le niveau du lac d’aval peut monter, le débit de la cascade ne changera pas tant que le lac d’aval ne sera pas au niveau du lac d’amont. C’est « tout ou rien ».
Ainsi, selon cette analogie, la PEPe n’a pas d’influence sur la ventilation du patient tant qu’elle n’atteint pas le niveau de la PEPi.
Effets de la PEPe chez un patient avec une limitation du débit expiratoire
Lorsque le patient est en ventilation spontanée et qu’il a une PEPi, le premier intérêt de régler une PEPe est de faciliter la prise de cycles respiratoires spontanés. En effet, la PEPi est une pression qu’il faut vaincre avant d’atteindre le seuil de déclenchement (trigger) d’un cycle respiratoire programmé sur la machine (en VS-AI ou en VAC). La PEPe vient compenser cette difficulté en décalant le seuil de déclenchement vers le haut. Si un patient à une PEPi = 8 cmH20, il va devoir combattre ces 8 cmH20 avant d’atteindre une pression nulle, puis produire une pression négative pour déclencher un cycle. En mettant une PEPe à 8 cmH20 qui égale la PEPi, le patient a moins d’effort à faire puisque la PEPe est égale à sa PEPi, il réussira mieux à déclencher un cycle.
Ensuite, on a prêté à la PEPe d’autres vertus pour améliorer la ventilation de ces patients, mais là c’est plus nébuleux, et les études sur le sujet comportent peu de patients.
J’ai trouvé un travail publié dans Crit Care Med en 2005 qui a testé l’effet de la PEPe chez des patients présentant une diminution du débit expiratoire. Les patients étaient curarisés.
La PEPe a été augmentée de zéro jusqu’à 1,5*PEPi avec une surveillance de plusieurs paramètres (gaz du sang, hémodynamique, mécanique ventilatoire.)
La principale conclusion de ce travail avec un faible effectif (8 patients !) c’est que l’effet de la PEPe n’est pas univoque. Les auteurs ont classé les résultats en trois catégories :
La réponse biphasique : tant que la PEPe n’excédait pas la PEPi, les paramètres étaient stables. Lorsque la PEPe dépassait la PEPi, ils observaient une aggravation de l’inflation thoracique.
Aggravation
d’emblée de l’hyperinflation thoracique : quelque soit le niveau de PEPe, la situation empirait
La réponse paradoxale : la PEPe a amélioré l’inflation thoracique avec une baisse de la pression de plateau.
Changes in functional residual capacity (FRC) assessed by inductive plethysmography. Individual responses along the incremental external positive end-expiratory pressure (PEEP) steps, from zero external-PEEP (reference) to a value matching 150% of intrinsic-PEEP measured at zero external-PEEP conditions. A, tidal volume (VT) = 6 mL/kg, respiratory rate (RR) = 6 breaths/min; B, VT = 6 mL/kg, RR = 9 breaths/min;C, VT = 9 mL/kg, RR = 6 breaths/min; D, VT = 9 mL/kg, RR = 9 breaths/min. The FRC measured at zero external-PEEP was considered as the reference. Points inside the gray zone indicate the occurrence of a paradoxic response.
Ainsi, il est possible que l’application d’une PEPe améliore la ventilation d’un patient avec une importante PEPi mais ce choix thérapeutique ne peut pas être recommandé systématiquement, et il ne peut s’agir que d’un test avec une incrémentation progressive de la PEPe et surveillance de l’évolution hémodynamique et ventilatoire.
Ce travail va un peu à l’encontre de la célèbre analogie de la cascade. Les explications des auteurs sont les suivantes :
l’analogie de la cascade est un modèle unicompartimental qui ne reflète pas l’hétérogénéité pulmonaire
la PEPe pourrait limiter le collapsus des bronchioles dans certaines zones
un secteur pulmonaire sans limitation du débit expiratoire pourrait influencer positivement une zone qui a une limitation du débit expiratoire. En étant caricatural, une alvéole bien ouverte (grâce à la PEPe) attachée à un système bronchique avec peu de résistance pourrait aider la vidange d’alvéoles adjacentes qui subissent une limitation du débit expiratoire. Les alvéoles d’un système moins malade appuieraient en quelque sorte sur les alvéoles aux bronches les plus malades.
la PEPe permettrait d’augmenter la rigidité bronchique et de faciliter le débit expiratoire
la PEPe permettrait de ralentir quelque peu le flux expiratoire. En ralentissant le flux gazeux engendre moins de variation de pression dans la bronche rétrécie ce qui diminuerait son risque de collapsus (cf Bernouilli)
En conclusion :
La PEPi a d’autant plus de risque d’être là que la patient est instable ou avancé dans sa pathologie
Chez un patient BPCO qui peut déclencher son respirateur, la PEPe a un grand intérêt pour contrecarrer la PEPi.
Chez un patient BPCO, la PEPe peut améliorer la PEPi mais ça n’est pas prévisible et elle peut aussi aggraver les choses.
Si la PEPe a un effet, c’est probablement via le système bronchique.
Au bloc opératoire avec un patient BPCO/asthmatique stable, la PEPe est à discuter au cas par cas. Avec un niveau de preuve moi-même comme on dit sur Twitter, j’aurais tendance à ne pas trop me focaliser sur ce point, il y a d’autres défis !
En réanimation, avec un patient très grave, la question prend tout son sens.
Le coin du bistrot :
en Médecine, on croit parfois faire un truc formidable avec de la poudre de perlimpimpin, le petit truc miracle. La PEPe n’est pas un truc miracle chez le BPCO. Il faut avant tout se focaliser sur le traitement de fond du bronchospasme.
lorsque vous ventilez, notamment au masque, un patient qui fait un bronchospasme, même si la situation est stressante, retenez-vous de le ventiler à 40 de fréquence ! Oxygénez le patient, appelez à l’aide et faite ce qu’il faut, mais de grâce ayant dans un coin de votre tête l’idée qu’il n’expire pas tout l’air que vous lui insufflez.
Baisse de la pression artérielle au bloc opératoire #recette #réflexes
Voici mes habitudes pour gérer une chute de la pression artérielle lors d’une anesthésie générale sans contexte particulier.
Première chose : la chute de la pression artérielle lors d’une anesthésie générale ça s’anticipe. Pour moi quatre facteurs contribuent à maintenir la pression artérielle :
Arrêt des IEC, des ARA 2 et du bloqueur de rénine
Gestion moderne du jeune conformément aux recommandations de la SFAR
Monitoring de la profondeur d’anesthésie dès que vous êtes préoccupé par le maintient de la pression artérielle
Titration des drogues d’anesthésie +++
Un plus pourrait être la surveillance de la pression artérielle par un outil non invasif.
J’insiste sur la titration des drogues d’anesthésie, bien souvent, le collapsus tensionnel est lié à une hypnose-analgésie trop profonde. La synergie hypnotique+morphinique est difficile à apprivoiser. En plus, nous autres gaziers sommes souvent victimes de pression de l’environnement au moment de l’induction. Keep calm and titrate
Lorsque la chute de la pression artérielle est là j’ai quelques réflexes :
envisager de mettre le patient en position de Trendelenburg -tête en bas, jambes en l’air- si on peutenvisager un lever de jambes si c’est réalisablecouper la PEP
diminuer voir arrêter les hypnotiques et les morphiniques (encore un intérêt du remifentanil
je jette un coup d’oeil à la capnie (EtCO2) : une baisse franche m’inquiète et dans ma tête clignote des alarmes (choc anaphylactique et phénomènes emboliques)
boli d’ephedrine rapproché par 9 mg
(parfois, rarement, j’augmente la FiO2 lorsque j’ai un doute sur la SpO2)
je demande une évaluation de l’hémoglobine au cas où un saignement aurait été sous estimé
si la situation reste précaire, j’essaye d’avoir un accès au coeur par les ultrasons pour mieux évaluer la situation

si je pense que la vasoplégie est le noeud du problème, j’administre de la noradrénaline, je n’utilise pas de phenylephrine
en seringue électrique continue (= SAP)
seringue purgée sur la SAP à l’aide de la fonction purge pour mettre en marche les micro-moteurs de la SAP, JAMAIS à la MAIN, et le premier qui me fait le coup de la petite bulle, il va au coin !
à une dilution de 0,2 mg/ml au bloc opératoire ou 16 gammas/ml
voie de bon calibre au bloc opératoire si pas d’accès veineux profond
avec surveillance de la voie veineuse
la noradrénaline sera au mieux administré via un système de « pieuvre »
il faut utiliser un fluide porteur et ne pas brancher la noradré « en direct », mon choix est une seringue de solution cristalloïde en débit continu à 5 ml/h
je tolère une administration de courte durée de la noradré sur une voie périphérique (moins de 6 heures)
si la situation empire réellement, il faut passer par la case soins intensifs/réanimation pour approfondir la réflexion et la surveillance en post-opératoire
P.S. à propos du débat Néo vs noradré, je copie colle ma réponse posté sur facebook : « A titre personnel, je préfère la noradré que la néo. La néo fait moins peur que la noradré, mais au final c’est couillon, c’est se voiler la face ! ce qui est emmerdant c’est la chute de pression artérielle, pas le médicament pour la traiter ! (de même certains ont peur du Valium et prescrivent du Tranxene, va comprendre pourquoi, c’est pareil !) »
PPS depuis l’été 2017, j’utilise préférentiellement de la noradrénaline diluée à 16 gammas/ml comme vous pouvez le lire là et là.
D T. PERIPHERAL NORADRENALINE [Internet]. [cited 2015 Dec 28]. Available from: http://www.scancrit.com/2015/06/10/peripheral-noradrenaline/
Genay S, Décaudin B, Scoccia S, Barthélémy C, Debaene B, Lebuffe G, et al. An in vitro evaluation of infusion methods using a syringe pump to improve noradrenaline administration. Acta Anaesthesiol Scand. 2015 Feb;59(2):197–204.
Genay S, Décaudin B, Ethgen S, Barthélémy C, Odou P, Lebuffe G. Impact of noradrenaline infusion set on mean arterial pressure: a retrospective clinical study. Ann Fr Anesth Reanim. 2013 Nov;32(11):e159-162.
Anesthésie pour chirurgie endoscopique ORL
Je travaille dans un service qui fait beaucoup d’endoscopies ORL et de chirurgie endolaryngée. J’aimerais partager avec vous ce que mes collègues m’ont appris sur l’anesthésie de ce type de chirurgie.
Pas d’explorations complémentaires nécessaires en routine (nous ne demandons aucune biologie, à l’exception d’un INR si relais AVK)
Nous utilisons les règles de jeune habituelles, mais notre vigilance est exacerbée et au moindre doute, nous plaçons le patient à jeun à minuit et on lui conseille un repas léger la veille au soir (les patients ayant une gastroplastie intrathoracique nécessitent beaucoup de vigilance sur ce sujet, j’en parle là et là)
Prémédication selon l’évaluation en consultation d’anesthésie, souvent de l’alprazolam, parfois rien (chirurgie récurrente)
Préoxygénation bien respectée
L’anesthésie démarre lorsque le chirurgien est dans le bloc (cf cette anecdote de polype laryngé)
Nous utilisons du remifentanil et du propofol en AIVOC, en cible cérébrale
Nous n’utilisons pas de curare. Pas de combo rocu-sug.
J’ai pour habitude de mettre deux trois cc de lidocaïne dans le propofol (c’est critiquable, mais c’est ce que je fais)
Titration de l’anesthésie générale par paliers
Ma pratique est la suivante :
Je commence par mettre une cible autour de 1 ng/ml de remifentanil en guise d’apéro
Puis je titre le propofol, classiquement, on navigue autour de 4-5 ng/ml de cible cérébrale
Puis j’augmente le remifentanil par palier, je programme 4 ng/ml de cible, puis j’augmente franchement autour de 10 ng/ml si nécessaire
Je garde un contact avec la main du patient pour tester son tonus. Pendant ce type d’intervention l’anesthésiste reste dans la salle.
Si le patient fait une bradycardie réflexe (vagal+remifentanil ?), je demande au chirurgien d’arrêter la laryngoscopie.
J’attends l’avis du chirurgien pour intuber le patient. Certaines chirurgies sont vraiment courte (ex injection bioplastique dans la corde vocale)
Si une intubation est nécessaire, nous mettons une sonde adaptée au traitement (laser ou pas)
Parfois, une solution élégante consiste à utiliser une jet-ventilation.
Si je n’intube pas le patient et qu’il désature, je le reventile gentiment au masque. En limitant la pression d’insufflation à 20cmH20 et parfois avec une pression cricoïde pour éviter de gonfler l’estomac.
Souvent, je diminue les doses de remifentanil drastiquement dès le début de l’intervention.
Si la chirurgie a été plus longue que prévue et/ou que les doses ont été importantes, il m’arrive d’intuber après la chirurgie pour sécuriser les voies aériennes et éviter l’hypercapnie.
Pour une panendoscopie simple, avec un opérateur entraîné, nous utilisons du propofol en titration et du remifentanil en titration IVD (dilution 25 µg/ml). Je commence par 1 à 2 µg/kg. L’utilisation du remifentanil en IVD peut choquer, mais pour ma part, je n’ai pas observé d’évènements indésirables comme une rigidité thoracique ou une bradycardie sévère. Je ne nie pas que ces effets indésirables existent, mais j’ai l’impression que c’est rare.
Précautions supplémentaires si chirurgie laser :
Ecriteau prévenant du danger sur la porte de bloc
FeO2 < 30%
Sonde dédiée à double ballonet gonflé à l’eau
Grande cupule d’eau et système d’injection prêt en cas de feu local
Linge humide sur le visage du patient
Le message important est la coopération entre l’anesthésiste et le chirurgien.
Anesthesia for ENT endoscopic surgery #FOAM
I work in a department with a lot of ENT endoscopies and endolaryngeal surgeries. I would like to share with you what my colleagues have taught me on anesthesia for this type of surgery.
No explorations (we do not ask for any biology, with the exception of a prothrombine time if coumadine is stopped)
We use the usual fast rules, but vigilance is exacerbated and when in doubt, we place the patient fasting at midnight and it is advised a light meal the night before (patients with intrathoracic gastroplasty require much vigilance on this subject, I speak here and there)
Premedication as assessed in consultation, often of alprazolam, sometimes nothing (recurrent surgery)
Preoxygenation well respected
Anaesthesia starts when the surgeon is in the OR (see this story)
We do not use curare. No rocu-sug combo.
We use remifentanil and propofol in TCI, brain target
I usually put three cc of lidocaine in the propofol, it is questionable, but it’s what I do)
Titration of general anesthesia as follows:
I start by putting a target around 1 ng/ml of remifentanil as an appetizer
Then I titrate propofol navigating around 4-5 ng/ml
Then I increase remifentanil in steps, I program 4 ng/ml target and frankly I increase around 10 ng/ml if necessary
I keep a contact with the patient’s hand to test its tone. During this type of intervention the anesthesiologist remains in the room all the time.
If the patient make a reflex bradycardia (increased vagal tone + remifentanil?), I ask the surgeon to stop laryngoscopy immediately.
I wait for the surgeon’s opinion to intubate the patient. Some surgery are really short (eg bioplastic injection into the vocal cord)
If intubation is required, I put a tube accordingly (laser or otherwise)
Sometimes an elegant solution is to use a jet ventilation.
If I do not intubate the patient and that desaturates, I kindly ventilate with a facial bag-mask. I avoid insufflation pressure above 20cmH20 and sometimes ask for cricoid pressure to limit air trapping in the stomach.
Often, I reduce the doses of remifentanil drastically from the start of the intervention.
If surgery was longer than expected and / or dosing were important, I intubate after surgery to secure the airway and prevent hypercapnia.
For a mere endoscopy with a trained operator, I use propofol and remifentanil in direct IV (remi’s dilution 25 mcg/ml). I start with 1 to 2 mcg/kg.
This use of remifentanil in IV may be shocking, but for my part, I did not observe any adverse events such as chest stiffness or severe bradycardia. I do not deny that these side effects exist, but I feel it is rare.
Extra precautions if laser surgery:
Sign warns of danger on the unit door
FiO 2 <30%
Dedicated probe double balloon inflated with water
Great cup of water and the injection system ready in case of local fire
Damp cloth on the patient’s face
The important message is the cooperation between the anesthesiologist and the surgeon.
De la plicature du tuyau
Je ne comprends pas la mode de la plicature de la sonde d’intubation.
Les sondes d’intubation sortent fonctionnelles de l’usine et je ne vois pas en quoi on arriverait mieux à intuber en pliant la sonde au milieu. Je pense même que c’est le contraire.
Les gens qui plient leur sonde espère aller chercher la glotte avec une sonde en épingle à cheveux. Ce truc ne fonctionne pas car j’ai observé deux choses :
– d’abord la sonde d’intubation de qualité reprend très rapidement sa forme naturelle
– ceussent qui plient leur sonde l’attrapent au milieu.
En faisant ainsi, ils se privent de la courbure de la sonde. Même avec un mouvement de poignet d’une grande amplitude, l’extrémité distale de la sonde fait moins de chemin vers le haut.
Ainsi, je pense qu’il faut avant tout apprendre à intuber ne tenant bien sa sonde à son extrémité proximale. Ce faisant, on dispose d’un bien plus grand rayon de courbure et l’extrémité de la sonde remonte plus facilement vers le plan glottique.
Les sondes sont bien faites, ne vous compliquez pas la vie.
Les béta-bloquants c’est pas tout le temps
Je me souviens bien d’une de mes premières visites pré-anesthésiques en premier semestre. Il s’agissait d’un patient au système cardio-vasculaire abîmé par le temps, la cigarette et un régime chti Deluxe. Peu habitué aux soins médicaux il n’avait pas de traitement. Les publications sur les béta-bloquants en périopératoire fleurissaient à l’époque et je me trouvais malin de réfléchir à une prescription d’un bétabloquant la veille de son intervention orthopédique… aujourd’hui je ne me pose plus ce genre de question, j’ai en effet un peu tendance à me méfier des béta-bloquants en périopératoire.
En 2014, les recommandations européennes conjointes de la société européenne de cardiologie et la société européenne d’anesthésie vont dans le sens d’une poursuite du traitement béta-bloquant s’il était instauré avant l’intervention. Pour démarrer un traitement, les recos sont beaucoup plus prudentes. Elles insistent sur le choix de la molécule (atenolol ou bisoprolol), sur le fait de cibler les patients les plus à risque (qui devraient déjà être béta-bloqués d’ailleurs) et sur la nature de la chirurgie. Enfin il ne faut pas se satisfaire de donner un béta-bloquant, il est impératif d’obtenir la fréquence cardiaque cible avec une bonne tolérance. Bref, pas simple.
La littérature sur les béta-bloquants en périopératoire est touffue. Il est très compliqué de se faire une idée soi même en remettant tout à plat. Certains articles majeurs (essais DECREASE) ont été jugés douteux (cf cette page sur Don Poldermans) et la méthodologie de l’essai princeps de Mangano serait à revoir (cf 919.full). De fait, plusieurs méta-analyses incluant ces travaux sont à mettre de côté. Enfin, l’essai POISE nous a montré que les béta-bloquants pouvaient apporter leur lot de complications (difficultés hémodynamiques et AVC aboutissant à une mortalité plus élevée ?).
Toutes ces informations me font regarder avec prudence l’idée d’une poursuite « automatique » des béta-bloquants en périopératoire. Ainsi j’ai tendance à être prudent (diminution de posologie le jour de l’intervention) avec les patients polymédiqués, fragiles, etc. Et sincèrement, je me demande l’intérêt de la poursuite du béta-bloquant chez le patient à faible risque (HTA seule). N’y a-t-il pas plus de risques d’hypotension importante que de bénéfice coronarien ?
Enfin, je pense qu’il faut être hyper-prudent avec les patients qui présentent des difficultés en post-opératoire : hémorragie, anémie, sepsis, syndrome inflammatoire important, etc. En chirurgie viscérale, on n’a pas facilement accès à la voie per os et je ne suis pas persuadé que l’administration en continu d’atenolol rende service au patient. J’ai en effet peur que le béta-bloquant précipite une hypotension ou gêne des mécanismes adaptatifs. Ainsi, sur le même modèle que mes réflexions sur la fibrillation auriculaire post-opératoire, je pense que l’on peut souvent se permettre d’attendre un peu pour mieux cerner la situation avant de dégainer l’atenolol en intraveineux. De même, je rappelle que les béta-bloquants ne sont plus administrés à la phase aigüe de l’infarctus.
En conclusion, cette note est un appel à la prudence vis à vis des béta-bloquants en périopératoire. Les béta-bloquants en phase aigüe sont probablement plus difficiles à manier qu’en phase chronique.
Beattie WS, Wijeysundera DN, Karkouti K, McCluskey S, Tait G, Mitsakakis N, et al. Acute Surgical Anemia Influences the Cardioprotective Effects of β-Blockade: A Single-center, Propensity-matched Cohort Study. Anesthesiology [Internet]. 2010 [cited 2014 Sep 24];112(1):25–33. Available from: http://journals.lww.com/anesthesiology/Abstract/2010/01000/Acute_Surgical_Anemia_Influences_the.13.aspx
Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. The Lancet [Internet]. 2008 [cited 2014 Sep 24];371(9627):1839–47. Available from: http://www.thelancet.com/journals/lancet/article/PIIS0140673608606017/abstract?isEOP=true
Mangano DT, Layug EL, Wallace A, Tateo I. Effect of atenolol on mortality and cardiovascular morbidity after noncardiac surgery. N Engl J Med. 1996 Dec 5;335(23):1713–20.
Bolsin S, Colson M. β blockers for patients at risk of cardiac events during non-cardiac surgery. BMJ [Internet]. 2005 Oct 20 [cited 2014 Sep 24];331(7522):919–20. Available from: http://www.bmj.com/content/331/7522/919 Download
Bolsin SN, Marsiglio A, Colson M. β-Blockers and cardiac protection. Br J Anaesth [Internet]. 2014 Oct 1 [cited 2014 Sep 22];113(4):721–2. Available from: http://bja.oxfordjournals.org.doc-distant.univ-lille2.fr/content/113/4/721 Download
Mon ami le potassium
Le potassium c’est dangereux, c’est un des premiers trucs qu’on apprend en médecine : il ne fait pas bon avoir 7 mmol/l de potassium dans le sang et il faut être très vigilant lors des prescriptions de supplémentation intraveineuse. Une kaliémie (très) élevée tue.
Cependant je préfère voir le potassium à 4,5 qu’à 3,5 mmol/l sur le ionogramme de mes patients, surtout en contexte post-opératoire. Il y a beaucoup de raisons qui concourent à trouver une hypokaliémie en post-opératoire : dénutrition, diminution des apports oraux, aspiration gastrique, diurétiques, nutrition parentérale, insuline. La renutrition trop rapide peut même aboutir à une hypokaliémie et une hypophosphorémie profonde avec des conséquences dramatiques. Il faut donc être particulièrement méfiant chez les grands dénutris, anticiper et surveiller.
Le potassium est le principal cation intracellulaire. Il est indispensable au maintient de la polarisation cellulaire et le travail de la Na/K ATPase représente probablement à l’échelle de l’organisme une proportion énorme de notre dépense énergétique de repos. Inutile de vous rappeler que le respect de ce gradient électrochimique est utile pour échapper à des tas de dysfonctionnements cardio-vasculaires ou neurologiques. Le potassium est également un cofacteur de la pyruvate kinase, enzyme plutôt utile.
Revenons à nos moutons : la kaliémie « normale-haute ». Pour ça j’essaye d’anticiper les apports chez les patients opérés, j’utilise préférentiellement le Ringer Lactate pendant les blocs, je veille à apporter régulièrement un peu de magnésium et je supplémente volontiers en phosphate dipotassique (contexte d’hypokaliémie/hypophosphorémie) ou en chlorure de potassium (en me souvenant de la chlorémie du patient). Il faut bien se souvenir que le pool potassique de l’organisme est énorme. Ainsi je pense qu’en dehors d’une fonction rénale précaire il est plus efficace d’apporter franchement le potassium (sur l’intervalle correct pour être safe bien sûr). Je retiens qu’il faut approximativement 200 mmol de potassium pour élever la kaliémie de 1 mmol/l chez un patient franchement carencé (attention aux contexte de transfert intracellulaire). 200 mmol d’ion K+ se trouve dans 15g de KCl
Par contre dès que la voie per os est utilisable, hop, potassium par la bouche, plus sécu et tout aussi utile ! De plus la physiologie est bien faite, si l’intestin et le rein sont fonctionnels ils ne se laisseront pas déborder par des apports élevés en potassium per os.
Je chasse donc activement les hypokaliémies qui favoriseraient la constipation, l’arythmie ou la faiblesse musculaire.
Je pense vraiment que la physiologie aime le potassium. Il y a beaucoup de travaux qui s’intéressent au déséquilibre entre les apports sodés et potassiques dans la genèse des pathologies cardio-vasculaires comme l’hypertension. Une alimentation riche en potassium (fruits et légumes) est régulièrement associée à des bénéfices sanitaires dans les études épidémiologiques.
D’autres sujets connexes sont passionnants comme l’utilité du mélange glucose-insuline-potassium (GIK) dans l’ischémie myocardique et les nouvelles pistes du rôle des pompes Na/K dans la régulation du cycle cellulaire. Mais c’est un tout autre sujet…
D’Elia L, Barba G, Cappuccio FP, Strazzullo P. Potassium intake, stroke, and cardiovascular disease a meta-analysis of prospective studies. J Am Coll Cardiol. 2011 Mar 8;57(10):1210–9.
He FJ, MacGregor GA. Beneficial effects of potassium. BMJ [Internet]. 2001 Sep 1 [cited 2014 Jun 4];323(7311):497–501. Available from: http://www.bmj.com/content/323/7311/497.pdf+html
Adrogué HJ, Madias NE. Sodium surfeit and potassium deficit: keys to the pathogenesis of hypertension. J Am Soc Hypertens. 2014 Mar;8(3):203–13. Download
Babula P, Masarik M, Adam V, Provaznik I, Kizek R. From Na+/K+-ATPase and cardiac glycosides to cytotoxicity and cancer treatment. Anticancer Agents Med Chem. 2013 Sep;13(7):1069–87.
Cheng CJ, Kuo E, Huang CL. Extracellular potassium homeostasis: insights from hypokalemic periodic paralysis. Semin Nephrol. 2013 May;33(3):237–47.
Pardo LA, Stühmer W. The roles of K(+) channels in cancer. Nat Rev Cancer. 2014 Jan;14(1):39–48.
Youn JH. Gut sensing of potassium intake and its role in potassium homeostasis. Semin Nephrol. 2013 May;33(3):248–56.
Aaron KJ, Sanders PW. Role of dietary salt and potassium intake in cardiovascular health and disease: a review of the evidence. Mayo Clin Proc. 2013 Sep;88(9):987–95.
Grossman AN, Opie LH, Beshansky JR, Ingwall JS, Rackley CE, Selker HP. Glucose-insulin-potassium revived: current status in acute coronary syndromes and the energy-depleted heart. Circulation. 2013 Mar 5;127(9):1040–8.
Fibrillation auriculaire en post-opératoire
La fibrillation auriculaire est fréquente après une chirurgie lourde, surtout s’il y a un abord thoracique. En chirurgie thoracique mon pifomètre me dit qu’il y a près de un patient sur trois qui fait un épisode de fibrillation auriculaire (FA).
Pour moi la FA est un signe d’alerte. J’évite de dégainer de l’amiodarone et de passer à autre chose. Je pense qu’il faut creuser un peu l’affaire. Je vous propose avec cette courte note ma « check-list passage en FA en post-opératoire ».
CHECK-LIST FA
Evaluer la tolérance. Il est urgent d’attendre et de réfléchir si le patient est stable
Rechercher une activation du système nerveux sympathique : douleur, hypovolémie-anémie-saignement, angoisse
Rechercher un sevrage en médicament : béta-bloquant et inhibiteur calcique surtout (et psychotrope si agitation et le cortège de signes habituels)
Optimiser les désordres hydro-électrolytiques, je préfère une kaliémie à 5 qu’à 3 mmol/l et j’ai la supplémentation en magnésium facile (cf la note ad hoc)
Rechercher l’ischémie coronarienne : terrain connu, à risque ?
Evoquer l’embolie pulmonaire
Traquer l’infection débutante, la fistule
Penser à l’épanchement péricardique
Mobiliser ou retirer un drain qui chatouille le coeur
Attraper un échographe pour rechercher une valvulopathie méconnue
On n’oubliera pas les histoires thyroïdiennes… (surdosage en hormone thyroïdienne, décompensation, etc.)
J’essaye donc de ne pas dégainer ni un anti-arythmique ni un anticoagulant trop vite. Ces deux traitements ont un pouvoir iatrogène immense. De plus se pose toujours la question de la durée du traitement devant un épisode post-opératoire où finalement « le stress opératoire » est souvent le déclencheur. Je trouve intéressant de prendre le temps d’observer l’évolution du phénomène lorsque la FA est bien tolérée par le patient. Il faudra probablement être plus proactif chez un patient porteur d’une cardiopathie évoluée.
Cette magnifique oreillette gauche vous est offerte par Philippe, cardiologue auteur du superbe (et drôle) blog http://echocardioblog.com/
Enfin, je pense que lors de l’apparition d’une fibrillation auriculaire il faut penser à bien notifier cet épisode au médecin traitant du patient et adresser secondairement le patient à un cardiologue car le passage en FA démasque souvent une cardiopathie latente (dysfonction diastolique débutante, dilatation oreillette gauche…)
UPDATE un article intéressant d’août 2014 montre l’intérêt de surveiller les patients qui font une FA post-op :
Perioperative Atrial Fibrillation and the Long-term Risk of Ischemic Stroke
Qu’en pensez-vous ?
P.S. quant à la FA dans le sepsis je vous conseille +++ de la respecter. Je sais que des travaux font miroiter d’autres hypothèses mais on est très très très loin d’une application clinique courante.
Gialdini G, Nearing K, Bhave PD & et al. PErioperative atrial fibrillation and the long-term risk of ischemic stroke. JAMA 312, 616–622 (2014). Download
Tisdale, J. E. et al. A randomized, controlled study of amiodarone for prevention of atrial fibrillation after transthoracic esophagectomy. J. Thorac. Cardiovasc. Surg. 140, 45–51 (2010).
Seely, A. J. E. et al. Systematic classification of morbidity and mortality after thoracic surgery. Ann. Thorac. Surg. 90, 936–942; discussion 942 (2010).
Amar, D. et al. Brain natriuretic peptide and risk of atrial fibrillation after thoracic surgery. J. Thorac. Cardiovasc. Surg. 144, 1249–1253 (2012).
Turaga, K. K., Shah, K. U., Neill, E. O. & Mittal, S. K. Does laparoscopic surgery decrease the risk of atrial fibrillation after foregut surgery? Surg Endosc 23, 204–208 (2009).
Stawicki, S. P. A. et al. Atrial fibrillation after esophagectomy: an indicator of postoperative morbidity. Gen Thorac Cardiovasc Surg 59, 399–405 (2011).
Raman, T. et al. Preoperative left atrial dysfunction and risk of postoperative atrial fibrillation complicating thoracic surgery. J. Thorac. Cardiovasc. Surg. 143, 482–487 (2012).
Bayraktar, U. D., Dufresne, A., Bayraktar, S., Purcell, R. R. & Ajah, O. I. Esophageal cancer presenting with atrial fibrillation: a case report. J Med Case Rep 2, 292 (2008).
Rao, V. P., Addae-Boateng, E., Barua, A., Martin-Ucar, A. E. & Duffy, J. P. Age and neo-adjuvant chemotherapy increase the risk of atrial fibrillation following oesophagectomy. Eur J Cardiothorac Surg 42, 438–443 (2012).
Ojima, T. et al. Atrial fibrillation after esophageal cancer surgery: an analysis of 207 consecutive patients. Surg. Today (2013) http://doi.org/10.1007/s00595-013-0616-3.
Bobbio, A. et al. Postoperative outcome of patients undergoing lung resection presenting with new-onset atrial fibrillation managed by amiodarone or diltiazem. Eur J Cardiothorac Surg 31, 70–74 (2007).
Merritt, R. E. & Shrager, J. B. Prophylaxis and management of atrial fibrillation after general thoracic surgery. Thorac Surg Clin 22, 13–23, v (2012).
Philip, I. et al. Fibrillation atriale en anesthésie–réanimation : de la cardiologie médicale à la période périopératoire. Annales Françaises d’Anesthésie et de Réanimation 31, 897–910 (2012).
Tisdale, J. E., Wroblewski, H. A. & Kesler, K. A. Prophylaxis of atrial fibrillation after noncardiac thoracic surgery. Semin. Thorac. Cardiovasc. Surg. 22, 310–320 (2010).
Le frisson post-opératoire
Le frisson post-opératoire est un phénomène curieux. Il peut être lié à l’anesthésie, quelles que soient ses modalités, ou à la chirurgie.
La première cause qui vient l’esprit est l’hypothermie. Durant une intervention le patient peut se refroidir facilement. Les principaux facteurs qui viennent à l’esprit sont les apports de fluides, la perte du frisson musculaire, la vasodilatation liée aux médicaments d’anesthésie (avec redistribution du sang périphérique vers le noyau central)
Les bons moyens de prévenir l’hypothermie sont de réchauffer les patients avant de les endormir (en salle de préanesthésie) et pendant l’intervention. Réchauffer les fluides est important si l’intervention est longue.
Le patient hypotherme est difficile à réchauffer endormi. Réchauffer à la fin *avant* de réveiller c’est un peu couillon parce c’est surtout l’arrêt de l’anesthésie et l’augmentation du métabolisme musculaire qui va favoriser le retour à une température normale.
Parfois un patient frissonne en salle de réveil alors qu’il est normotherme. La première cause facile à comprendre est la réaction inflammatoire liée à une chirurgie lourde. Ca se voit surtout en chirurgie cardiaque avec circulation extra-corporelle. Les autres causes sont plus complexes.
Les médicaments d’anesthésie pourraient interférer sur la régulation hypothalamique de la température corporelle en créant un décalage dans le seuil du frisson. Ensuite il existe des phénomènes encore plus compliqués de blocage de certaines voies inhibitrices sur la moelle pouvant entrainer des mouvements anormaux d’une autre nature que le frisson lié à l’hypothermie.
Toujours est-il que ce phénomène ne met pas en danger le patient. On dispose de moyen médicamenteux très efficace (clonidine, nefopam, magnésium) pour prévenir et traiter le frisson post-opératoire. Ces traitements agissent beaucoup plus vite que le réchauffement externe.
En conclusion, je pense qu’il est bon de dépister les antécédents de frissons post-op en consultation d’anesthésie et de prévenir leur apparition. Les médicaments sont peu coûteux et efficaces, ne vous en privez pas.
Park SM, Mangat HS, Berger K, Rosengart AJ. Efficacy spectrum of antishivering medications. Critical Care Medicine [Internet]. 2012 [cited 2012 Oct 20];40(11):3070–82. Available from: http://journals.lww.com/ccmjournal/Abstract/2012/11000/Efficacy_spectrum_of_antishivering_medications__.19.aspx
Magnésium et anesthésie
Le magnésium est un cation majoritairement intracellulaire. Il n’y a que 1% du pool magnésien en extracellulaire. On peut globalement retenir que le magnésium a un effet inhibiteur calcique. L’administration de magnésium peut être utile comme adjuvant aux médicaments permettant une anesthésie générale.
Beaucoup d’études montrent une association entre l’hypomagnésémie et la morbi-mortalité en péri-opératoire ou en soins intensifs. Comme le répète toujours Dominique Dupagne avec ses #StatsALaCon dans La Tête au Carré (#LaTac) corrélation n’est pas causalité ! Ca n’est pas parce qu’on meurt souvent dans un lit que les lits sont dangereux ! Fin de l’a parte
Néanmoins ces résultats donnent envie de rechercher dans la physiologie et de proposer des essais thérapeutiques. De plus il est fréquent de voir en post-opératoire des traitements pouvant favriser une hypomagnésémie : diurétiques, gentamycine et ciclosporine notamment.
A l’échelle cellulaire le magnésium influence lourdement la machinerie énergétique cellulaire et les échanges ioniques soit transmembranaires soit intracellulaires entres certains organites et le cytoplasme. On peut retenir que le magnésium a un effet stabilisant de membrane.
Sa répartition dans l’organisme rend peu utile les dosages plasmatiques (ou intracellulaire) en routine.
L’impact du magnésium sur le muscle lisse impose de la prudence dans son administration car le relâchement du muscle lisse peut se manifester sous forme d’un collapsus tensionnel. Je préfère ainsi les administrations progressives et j’évite de mettre un bolus de magnésium en même temps que l’induction anesthésique.
Le magnésium va également avoir un intérêt dans l’analgésie per et postopératoire. Il contribue avec la kétamine à bloquer le canal NMDA.
J’utilise donc le magnésium en anesthésie pour ces deux raisons principales : j’espère limiter le risque de passage en fibrillation auriculaire chez les patients à risque (OG dilatée, chirurgie lourde, thoracotomie) et je pense qu’il participe à l’analgésie.
Les autres raisons qui me poussent à utiliser du magnésium sont les suivantes :
limiter le risque d’hypokaliémie, je préfère une kaliémie normale/haute à une kaliémie normale/basse
faciliter la reprise du transit en chirurgie digestive (épargne morphinique + effet propre stimulant le transit)
relâchement du muscle bronchique, les fumeurs et les patients BPCO sont de bons candidats au magnésium en périopératoire
participe à la prévention du frisson post-opératoire
en cas d’utilisation de fluoroquinolones (bouh!) il semblerait que le magnésium puisse avoir un effet protecteur sur les effets indésirables tendineux
potentialiser le relâchement musculaire, notamment si le patient a une contre-indication aux curares
peut-être une place dans la chirurgie du phéochromocytome (mais la littérature me laisse un peu dubitatif)
les rapport coût/bénéfice et bénéfice/risques me paraissent très favorable
Attention à particulièrement bien surveiller le bloc-neuromusculaire lorsque l’on utilise des curares et du magnésium. Le magnésium potentialise l’action des curares.
Je vous conseille particulièrement la lecture de la revue de la littérature par le Pr Dubé que vous trouverez dans la biblio ci-dessous.
Farkas, J. PulmCrit: Pulmonary Intensivist’s Blog: Magnesium infusions for atrial fibrillation & torsade. http://www.pulmcrit.org/2015/11/magnesium-infusions-for-atrial.html.
Liu, H. T., Hollmann, M. W., Liu, W. H., Hoenemann, C. W. & Durieux, M. E. Modulation of NMDA receptor function by ketamine and magnesium: Part I. Anesth. Analg. 92, 1173–1181 (2001).
Fawcett, W. J., Haxby, E. J. & Male, D. A. Magnesium: physiology and pharmacology. Br J Anaesth 83, 302–320 (1999).
Whang, R. & Ryder, K. W. Frequency of hypomagnesemia and hypermagnesemia. Requested vs routine. JAMA 263, 3063–3064 (1990).
Tramer, M. R., Schneider, J., Marti, R. A. & Rifat, K. Role of magnesium sulfate in postoperative analgesia. Anesthesiology 84, 340–347 (1996).
Albrecht, E., Kirkham, K. R., Liu, S. S. & Brull, R. Peri-operative intravenous administration of magnesium sulphate and postoperative pain: a meta-analysis. Anaesthesia (2012) http://doi.org/10.1111/j.1365-2044.2012.07335.x.
Rowe, B. H. et al. Magnesium sulfate for treating exacerbations of acute asthma in the emergency department. in Cochrane Database of Systematic Reviews (eds. The Cochrane Collaboration & Rowe, B. H.) (John Wiley & Sons, Ltd, Chichester, UK, 2000).
Do, S.-H. Magnesium: a versatile drug for anesthesiologists. Korean J Anesthesiol 65, 4–8 (2013).
Dubé, L. & Granry, J.-C. The therapeutic use of magnesium in anesthesiology, intensive care and emergency medicine: a review. Can J Anaesth 50, 732–746 (2003).
Herroeder, S., Schönherr, M. E., De Hert, S. G. & Hollmann, M. W. Magnesium--essentials for anesthesiologists. Anesthesiology 114, 971–993 (2011).
Solomon, R. The relationship between disorders of K+ and Mg+ homeostasis. Semin. Nephrol. 7, 253–262 (1987).
La lidocaïne comme analgésique intraveineux
La lidocaïne intraveineuse a des vertus analgésiques. Son utilisation comme anesthésique local ou pour une anesthésie loco-régionale est bien connue mais en IV ce médicament reste peu usité en France.
Après l’ECN, en bon polard, j’ai acheté mon premier livre d’anesthésie à l’étranger. Clinical Anesthesiology de Morgan. Evidemment je ne comprenais rien à ce bouquin. Spécialité mystérieuse. Je me souviens avoir été particulièrement surpris de l’utilisation de la lidocaïne en IV pour intuber. Une fois que j’ai commencé les stages d’interne, je n’ai jamais vu personne utilisé de la lidocaïne en IV pour faciliter une intubation. J’ai commencé à me demander si ça relevait de la science-fiction…
Les années passent et la lidocaïne revient à la mode avec la réhabilitation précoce en chirurgie viscérale, en IV elle permettrait un compromis entre analgésie et reprise précoce du transit. Je me souviens alors de mon grimoire anglo-saxon et j’entends aussi de vieilles légendes sur des docteurs qui utilisaient la lidocaïne comme analgésique dans la pancréatite aigüe.
Les années filent, et je deviens franchement responsable de ce que j’injecte au patient. Je creuse le sujet, je trouve ça intéressant. Je fais de plus en plus de lidocaïne et je me rends compte que ça se passe bien, je mets moins d’hypnotique et moins de morphinique. Malgré tout la lidocaïne continue de faire peur : sur les flacons à 1 et 2% c’est bien écrit « ne pas injecter en intraveineux » (une histoire d’AMM) et on nous rabache les oreilles dans les cours d’anesthésie loco-régionale sur les complications neurologiques et cardio-vasculaire d’une intoxication aux anesthésiques locaux. Tout ça ne pousse pas à la consommation et au développement de l’utilisation du produit…
C’est dommage parce que je pense que la lidocaïne pourrait rendre un paquet de service. En atteignant une masse critique de prescripteurs de lidocaïne en intra-veineux on créerait une culture intéressante de l’épargne morphinique et les soignants comprendrait mieux son utilisation et ses risques.
Bref. Moi j’aime bien la lidocaïne en intraveineux car elle joue sur plusieurs cibles :
– les canaux sodiques voltage-dépendants, notamment ceux qui se multiplient après une lésion nerveuse
– certains récepteurs médullaires muscariniques jouant sur l’inhibition descendante des voies de la douleurs,
– elle peut moduler l’action de canaux NMDA
– elle peut avoir des vertus anti-inflammatoires
En plus des papiers démontrent une activité antimicrobienne en destabilisant la membrane de certains germes, interesting…
Donc en pratique, je l’utilise souvent à 1,5 mg/kg à l’induction (après avoir fait des petites doses d’hypnotiques et de kétamine qui augmentent le seuil épileptogène, on n’est jamais à l’abri d’un gag) et une SAP per-op entre 1 et 2 mg/kg/heure (le XYLOCARD 5% est pratique, utilisé pur de 1 à 4 ml/h). J’aimerais qu’on la continue en post-opératoire mais la routine n’est pas acquise, on reste donc un peu frileux à l’heure actuelle sur le sujet.
L’hydroxyzine, c’est pas ma copine
Je n’aime pas l’ATARAX. Rien que le nom m’énerve. Je suspecte le marketing d’être en partie responsable de la grande consommation d’hydroxyzine en ville (avec le P4P qui veut écarter les benzos, alors on retrouve de l’hydroxyzine sur les ordonnances…) et dans nos hôpitaux. Si la prescription en dci était obligatoire, on en verrait peut être moins à tout bout de champ !
On va tout de suite écarter le dogmatisme, ça n’est pas parce que je n’aime pas une molécule que je la raye de ma pharmacopée. Je l’utilise en prémédication chez des patients pluri-allergiques et chez les patients les plus à risque de NVPO. Je ne l’utilise vraiment pas en routine car son pic d’action est lent, peu compatible avec une administration juste avant d’aller au bloc.
Mais j’évite de l’utiliser comme sédatif comme je le vois si souvent la nuit en garde… La première raison c’est que je trouve que c’est une mauvaise molécule dans cette indication. Je trouve cette molécule clairement pas anxiolytique et je trouve ses effets sédatifs aléatoires. Ensuite je pense qu’elle génère pas mal d’effets indésirables qu’on sous-estime. L’hydrozyxine a notamment des propriétés anti-cholinergiques qui peuvent être très mal vécues par les patients, notamment âgés : rétention aigüe d’urine, syndrome confusionnel et constipation. Ses effets atropiniques s’ajouteront à celui du nefopam déjà prescrit pour l’analgésie pour faire un cocktail détonnant.
Ainsi je préfère clairement d’autres molécules pour prendre en charge les patients confus et/ou agités. Une fois que les causes médicales classiques ont été recherchées et écartées, je prescris volontiers des benzodiazépines en première intention : oxazepam quand la voie per os est utilisable, sinon je craque pour du midazolam voire du diazepam en IV. Je n’ai pas peur de la dépression respiratoire car aux posologies thérapeutiques je ne pense pas que ce risque soit important et quand bien même ce choix aurait été mauvais on dispose d’un antidote très efficace. Donc oui aux benzos pour les agitations aigües ! En deuxième ligne, si le patient est correctement hydraté et qu’il semble souffrir d’un syndrome confusionnel grave, je n’hésite pas à utiliser des neuroleptiques à petites doses : halopéridol en première intention et cyamémazine en deuxième ligne. J’associe aussi volontiers de la clonidine.
IMHO Je pense que l’Atarax n’est pas un Smarties et on ferait bien de réfléchir à deux fois avant de le dégainer.
Update : médicament anticholinergique et démence au long cours : http://archinte.jamanetwork.com/article.aspx?articleid=2091745
Update : le Canada a revisé les posologies et les contre-indications à cause de l’allongement du QT
La clonidine
La clonidine est un alpha-2 agoniste adrénergique. Le récepteur α2 a pour ligand naturel la noradrénaline, neurotransmetteur essentiel du système sympathique. La clonidine a une affinité 200 fois plus grande pour le récepteur α2 que pour le récepteur α1. Sa biodisponibilité per os est proche de 100%. Sa demi-vie est longue : 12 à 24 heures. La moitié de la dose absorbée est excrétée inchangée dans les urines. L’insuffisance rénale ralentit l’élimination de la clonidine.
Le récepteur α2 est majoritairement présynaptique. Son rôle physiologique est de participer au rétrocontrôle négatif de la sécrétion de noradrénaline. En se liant au récepteur α2 présynaptique, la clonidine diminue la sécrétion de noradrénaline dans la fente synaptique.
Une des actions les plus visibles de la clonidine est de déprimer les noyaux vasomoteurs dans le tronc cérébral, gommant ainsi à la fois le tonus de base et la réactivité sympathique. La clonidine induit donc une tendance à la bradycardie et à l’hypotension.
Par ailleurs, la noradrénaline a des vertus analgésiques par le biais des récepteurs α2 notamment dans la corne dorsale de la moelle. Cet effet est cohérent avec la logique « Fight or Fly » du système sympathique. Par son affinité au récepteur α2 la clonidine active les mêmes voies intracellulaires que la noradrénaline endogène. Il s’agit d’ouvrir un canal potassique facilitant « l’hyperpolarisation » de neurones WDR (wide dynamic range), déprimant ainsi leur activité. Ces neurones sont habituellement stimulés par des fibres Aδ ou C provenant de la périphérie. La clonidine peut donc émousser un afflux nerveux nociceptif.
Ensuite, la clonidine va également agir au niveau du loecus coeruleus lié à la régulation de l’état de veille. La stimulation α2 va provoquer une sédation avec un certain de gré d’indifférence à l’environnement propice à une utilisation en réanimation.
Ainsi, le tableau général qui résulte de l’action de la clonidine est un blocage des effets hémodynamiques de la noradrénaline endogène (diminution activité α1+++) tout en conservant l’activation de systèmes analgo-sédatifs.
La clonidine peut être utile au patient en pré- per- et post-opératoire. Elle est ainsi utilisée en prémédication, en pédiatrie et chez les adultes . A titre personnel, je l’utilise souvent dans mes prémédications, surtout lorsque j’arrête des IEC des ARA2 ou l’aliskiren avant une intervention. Je propose de la clonidine (1 à 2 µg/kg) per os si le patient a une pression artérielle élevée à son arrivée à l’hôpital (stress et diminution de l’imprégnation par les bloqueurs du système rénine angiotensine) voire même le matin de l’intervention.
En périopératoire, on observe que la clonidine potentialise les effets des hypnotiques et des morphiniques. Ainsi lorsque l’on emploie de la clonidine, on peut très sensiblement diminuer les posologies de propofol, de gaz halogénés et des morphiniques en per et en post-opératoire . Lorsque l’on est peu habitué à manier la clonidine, la peur de la douleur ou d’une profondeur d’anesthésie insuffisante fait que l’on poursuit les hypnotiques et les morphiniques à des posologies usuelles. Dans cette situation on bascule clairement rapidement dans une situation de surdosage anesthésique avec des conséquences hémodynamiques marquées. Cela sera d’autant plus visible que la clonidine a été administré en bolus à un patient en hypovolémie (relative ou patente.)
Ces manifestations font craindre une mauvaise perfusion tissulaire. Pour moi, il faut d’abord nourrir la réflexion autour de deux axes avant d’accuser les α2 agonistes de compromettre la perfusion tissulaire :
D’abord, je pense qu’il existe des situations où il y a un décalage entre ce qui se passe au niveau macrocirculatoire (que l’on voit et mesure) et au niveau microcirculatoire. La clonidine abaisse vraisemblablement les résistances vasculaires systémiques mais avec un patient stable, de chirurgie programmée ayant une volémie adéquate, je pense que le débit cardiaque reste adapté (la VO2 baisse sensiblement pendant une anesthésie générale.) Pour prolonger cette réflexion il y a des études en chirurgie cardiaque qui montre que l’utilisation de la clonidine permettrait d’éviter des accidents ischémiques myocardiques . Il y a fort à penser que les variations hémodynamiques brutales et les décharges de catécholamines sont ce qu’il y a de plus délétères pour les « patients vasculaires ». Ainsi la clonidine trouve une raison d’être dans le contrôle du stress sympathique qui dépasse parfois les capacités adaptatives du patient.
Dans la littérature scientifique le blocage des voies noradrénergiques n’a pas d’effet hémodynamique dramatique (surtout en terme de pronostic) lorsque la clonidine est testée seule, notamment avec une administration lente et continue pour une sédation en réanimation. Comme je l’écrivais plus haut, je pense qu’il faut que nous apprenions à manier correctement la clonidine. Malheureusement les recommandations sur l’analgésie ne nous encouragent pas à ça puisque la SFAR ne recommande purement et simplement pas son utilisation comme adjuvant d’une anesthésie générale et comme antalgique en post-opératoire. Il me parait vraisemblable que ce désamour vienne d’un manque de culture dans le maniement de ce médicament. Les anesthésistes qui utilisent de fortes doses d’α2 agonistes comme certaines équipes belges ou les réanimateurs anglo-saxons qui l’utilise comme sédatif nous prouvent dans leurs travaux qu’il y a une place pour une utilisation bénéfique pour le patient, à nous d’apprendre auprès d’eux !
La clonidine peut s’utiliser selon différentes voies d’administrations, en intraveineux ou en périmédullaire notamment. Les conséquences hémodynamiques sont comparables. Lors d’une utilisation en épidural, les agents anticholinestérasiques comme la neostigmine peuvent aider à maintenir une hémodynamique rassurante. L’équipe bruxelloise de Marc De Kock qui cherche à limiter les morphiniques au maximum utilise parfois exclusivement la clonidine en péridural pour l’analgésie . Frappant non ?
Les α2 agonistes ont d’autres vertus intéressantes. La clonidine a des effets sur la thermorégulation. Ainsi, elle est utile pour prévenir le frisson post-anesthésique à la physiopathologie complexe . La clonidine joue également un rôle préventif des nausées et vomissements post-opératoires (NVPO) . Il est fort probable que la diminution des besoins en morphiniques soit l’explication principale. En anesthésie loco-régionale, la clonidine prolonge les effets des anesthésiques locaux . Il existe aussi des propriétés méconnues avec des pistes de recherche à défricher : effet diurétique (effet sur l’ADH et l’ANP ?) et effet d’épargne azoté .
La plus grande difficulté est de se construire une expérience solide pour trouver les bonnes indications où la clonidine apporte un plus aux patients. Pour moi les jeunes avec un terrain très neurotonique, les addictifs sévères (énervés ou qui peuvent le devenir rapidement…), les douloureux chroniques (ou un terrain à risque), les coronariens qui s’accélèrent et qui montent leur pression artérielle sont de bonnes indications. Lorsque j’en ai la possibilité j’utilise préférentiellement la clonidine en périmédullaire avec une administration continue plutôt qu’en bolus IV.
En réanimation, la clonidine, et sa cousine la dexmetomidine constitue des sédatifs intéressants dont l’utilisation reste à définir. Une revue récente de l’utilisation des α2 agonistes en réanimation a été publiée dans les AFAR , c’est un must-read.
Enfin la clonidine et la recherche fondamentale autour des α2 agonistes précisent notre compréhension des mécanismes de l’anesthésie générale. Nos collègues de la médecine vétérinaire ont notamment bien creusé la piste de l’utilisation des α2 agonistes pour induire une hypnose mais ils ont aussi testé avec succès la réversion de l’anesthésie avec l’utilisation d’α2 antagoniste comme l’atipamezole .
Notez aussi pour l’anecdote que sur la piste de la stimulation des voies noradrénergiques pour moduler l’état de veille, des médicaments construits et vendus comme « psychostimulants » (le modiodal et son ancienne prodrogue l’adrafinil) ont été détournés de leur usage médical comme dopant.
En conclusion, je pense que la modulation du système sympathique est une voie de recherche passionnante pour les anesthésistes-réanimateurs, ne mettons pas trop vite les α2 agonistes de côté, cherchons plutôt à mieux les apprivoiser et puis qui sait peut être qu’un jour on facilitera le réveil d’une anesthésie générale en utilisant des alpha2-antagonistes …
POST-SCRIPTUM : j’utilise la clonidine comme ça : 4 amp de 150 µg (=600 µg) dans 20 ml sur une seringue trois pièces. En seringue auto-pulsée, je titre pour que le patient soit calme aux soins intensifs et/ou sur l’hémodynamique au bloc. Je commence souvent à 1 µg/kg/heure (environ 2 ml/h), moins chez la personne âgée et je titre. J’ai remarqué que l’efficacité pointait tranquillement le bout de son nez lorsqu’on avait atteint 1 µg/kg. La lecture de l’article de l’AFAR est vraiment intéressant, lisez le ! n’oubliez pas que ça n’est pas une panacée, qu’il existe des situations où ça n’est pas le médicament adéquat…
La kétamine
La kétamine est ma molécule anesthésique favorite. A la fois molécule sérieuse et mystérieuse elle connait un franc regain d’intérêt depuis la prise en compte de l’hyperalgésie post-opératoire.
La kétamine peut s’administrer sous plusieurs formes : IV, IM, po ou IR sont les voies les plus communes. Après une administration IV elle se fixe très rapidement sur ses récepteurs notamment au niveau cérébral. Son volume de distribution est élevée, elle est peu liée aux protéines plasmatiques. Le métabolisme est très majoritairement hépatique. L’insuffisance rénale avancée augmente tout de même la concentration plasmatique de l’ordre de 20%. La molécule n’est pas épurée en dialyse. La demi-vie de la molécule est de 2 à 3 heures. Il faut noter que la kétamine est rapidement métabolisée en nor-kétamine, métabolite actif qui sera éliminé beaucoup plus lentement pouvant participer aux bénéfices analgésiques ou aux inconvénients psycho-dysleptiques.
La kétamine va avoir pour effet de bloquer le canal calcique NMDA au niveau central (médullaire et surtout supramédullaire) Ce faisant, elle va pouvoir créer à des doses de 2 à 3 mg/kg une anesthésie dite dissociative. Le patient semble vigil mais il n’est plus connecté avec la réalité. On ne peut pas communiquer avec lui, et il ne montre pas de signes pouvant se traduire par une réaction douloureuse. A des doses moindres (0,5 mg/kg) la kétamine va avoir des propriétés anti-inflammatoires et analgésiques.
La kétamine a peu d’effets hémodynamique ou respiratoire gênants. Cela en a fait la molécule de choix pour pratiquer l’anesthésie dans des milieux à la surveillance limitée (médecine humanitaire, préhospitalier) ou pour anesthésier des patients en états de choc (hémorragique, tamponnade, crise d’asthme grave, etc.)
Concernant l’hémodynamique la kétamine utilisée seule stimule le système nerveux sympathique, augmente la fréquence cardiaque, la consommation d’oxygène du myocarde etc. En utilisant la kétamine avec de faibles doses de benzodiazépines ou d’hypnotiques comme je pense que nous le faisons majoritairement dans les blocs opératoires et les salles d’urgences ces effets n’existent plus, il faut oublier ce truc de textbook des seventies qui dit : « pas de ketamine chez le coronarien »…
La kétamine ne gêne pas (ou si peu) la mécanique ventilatoire comme ses cousines hypnotiques. Mieux : elle maintient le tonus des muscles des voies aériennes supérieures, c’est la molécule idéale pour faire de l’analgésie en préhospitalier dans le cadre d’une désincarcération par exemple. Elle a également des propriétés bronchodilatatrices.
Quant à l’effet sur le cerveau il est plutôt complexe. Néanmoins il faut aussi oublier cette vieille contre-indication de l’hypertension intracrânienne car de petites doses d’hypnotiques émousseront clairement la stimulation sympathique qui augmentait le débit sanguin cérébral. En cas de traumatisme crânien sévère associé à un collapsus (polytrau, hémorragie, etc) c’est même cette molécule qui préservera le mieux la pression artérielle moyenne pour avoir une pression de perfusion cérébrale satisfaisante. Ensuite après avoir subi une mauvaise presse fin des années 1970-début 1980 sur une imputabilité douteuse dans des crises convulsives, la kétamine est désormais vu comme pouvant avoir des propriétés neuroprotectrices. Elle peut être tentée comme traitement de secours lorsqu’un état de mal convulsif ne cède pas avec les drogues usuelles.
La kétamine est également peu histaminolibératrice, son utilisation ne pose pas de soucis chez les patients myopathes ou aux antécédents d’hyperthermie maligne. La prudence reste de mise en cas de porphyrie.
» – Voilà une bonne molécule d’anesthésie non ?
– oui mais les patients ne sont-ils pas plus à risque de troubles cognitifs post-opératoires ? »
C’est vrai que c’est une récrimination classique. La littérature ne va pas forcément dans ce sens, avec une étude en chirurgie cardio-vasculaire qui ne montre pas une plus grande incidence de troubles cognitifs post-opératoire avec la kétamine. De même chez les psychotiques ou les dépressifs sévères, la kétamine utilisée à bon escient pourrait même être bénéfique ou protectrice pour ces patients (pas mal de recherches en cours sur la dépression sévère notamment). Quant aux personnes âgées, j’ai lu que c’était le pic de concentration cérébrale qui semblait être le plus pourvoyeur d’effets pyscho-dysleptiques, je modère donc les doses de kétamine, et je l’administre en IVL (dans le Ringer) plutôt qu’en IVD.
Aujourd’hui dans les blocs opératoires la kétamine est plutôt utilisée pour prévenir l’hyperalgésie que pour l’hypnose. Grosso modo, l’hyperalgésie c’est ce que vit un patient qui échappe au contrôle de la douleur par la morphine. Plus on administre de morphine, plus les systèmes parallèles de relais de l’information douloureuse sont sollicités. Quand on bloque très fort les voies de la nociception en liant un morphinique au récepteur µ, on fait d’autant ressortir d’autres voies comme celles liées au glutamate et à son canal calcique récepteur, le canal NMDA. Dans la corne dorsale de la moelle, la plasticité neuronale se met en jeu pour faciliter le passage de l’information douloureuse avec pour conséquences cliniques une allodynie et/ou une hyperalgésie. La kétamine bloque le canal NMDA.
En pratique, dans notre hôpital l’utilisation est « protocolée ». Au bloc opératoire où l’on pratique de la chirurgie générale (endocrinienne, viscérale, urologique et vasculaire) on administre un bolus de 0,5 mg/kg à l’induction, puis on fait une administration continue (seringue de 100 mg de kétamine dans 50 ml) à 0,1 mg/kg/h. Et dans les 48 premières heures post-opératoires on poursuit la SAP à 0,05 mg/kg/h.
Dans la série détails qui comptent : je fais toujours un hypnotique avant l’administration de la kétamine. Il n’y a pas d’intérêt à commencer par la kétamine dans sa séquence d’induction. Deuxième détail : j’essaye au maximum de couper la SAP de kétamine avant la fin du bloc, en effet la kétamine et son métabolite déméthylé (nor-kétamine) peuvent participer à l’hypnose et retarder le réveil du patient.
La kétamine se révèle aussi souvent efficace pour atténuer des syndromes douloureux complexes « résistants » aux morphiniques ou aux traitements usuels : anti-épileptiques, TENS, etc. Malheureusement il existe peu de structures qui peuvent accueillir les patients pendant plusieurs jours d’affilée en hospitalisation pour les « imprégner » de kétamine en vue d’obtenir un effet rémanent.
1.Liu HT, Hollmann MW, Liu WH, Hoenemann CW, Durieux ME. Modulation of NMDA receptor function by ketamine and magnesium: Part I. Anesth Analg. 2001 May;92(5):1173–81.
2.Bell RF, Dahl JB, Moore RA, Kalso E. Peri-operative ketamine for acute post-operative pain: a quantitative and qualitative systematic review (Cochrane review). Acta Anaesthesiol Scand [Internet]. 2005 Nov [cited 2012 Aug 26];49(10):1405–28. Available from: http://www.ncbi.nlm.nih.gov/pubmed/16223384
3.Chia YY, Liu K, Wang JJ, Kuo MC, Ho ST. Intraoperative high dose fentanyl induces postoperative fentanyl tolerance. Can J Anaesth. 1999 Sep;46(9):872–7.
4.Hollmann MW, Liu HT, Hoenemann CW, Liu WH, Durieux ME. Modulation of NMDA receptor function by ketamine and magnesium. Part II: interactions with volatile anesthetics. Anesth Analg. 2001 May;92(5):1182–91.
5.Kranaster L, Hoyer C, Janke C, Sartorius A. Preliminary evaluation of clinical outcome and safety of ketamine as an anesthetic for electroconvulsive therapy in schizophrenia. World J Biol Psychiatry. 2012 Mar 8;
6.Kudoh A, Katagai H, Takazawa T. Anesthesia with ketamine, propofol, and fentanyl decreases the frequency of postoperative psychosis emergence and confusion in schizophrenic patients. J Clin Anesth. 2002 Mar;14(2):107–10.
7.Hudetz JA, Iqbal Z, Gandhi SD, Patterson KM, Byrne AJ, Hudetz AG, et al. Ketamine attenuates post-operative cognitive dysfunction after cardiac surgery. Acta Anaesthesiol Scand. 2009 Aug;53(7):864–72.
8.Himmelseher S, Durieux ME. Ketamine for perioperative pain management. Anesthesiology [Internet]. 2005 [cited 2012 Sep 18];102(1):211. Available from: http://journals.lww.com/anesthesiology/Abstract/2005/01000/Ketamine_for_Perioperative_Pain_Management.30.aspx
Les perfusions post-opératoires
Je trouve que les prescriptions post-opératoires sont parfois un peu alambiquées. J’aimerais par le biais de quelques billets expliquer ma stratégie pour des prescriptions claires.
En préambule, je rappelle que des prescriptions ça se date et ça se signe. Les voies d’administrations doivent être précisées, il ne doit pas y avoir d’ambiguïté.
Les perfusions post-opératoires
Il faut les limiter au maximum. Tous les traitements peuvent générer de la iatrogénie, y compris les perfusions : erreurs d’électrolytes, hyponatrémie, infection de cathéter, débit trop rapide de nutrition parentérale, etc.
Si le patient boit et mange dès le retour de bloc, je demande à ce que la perfusion soit obturée. Point final. Dans ma pratique j’ai une exception : les chirurgies vasculaires qui recoivent des produits de contraste iodés. Pour eux je prescris une solution salée isotonique à 1 ml/kg/h pendant 6 à 12 heures post-op (selon le degré d’insuffisance cardiaque)
Pour les patients qui ne mangent pas, je prescris une hydratation avec le fameux POLYIONIQUE de l’anesthésiste : une solution glucosé à 5% avec 4 g/l de NaCl et 2 g/l de KCl. J’essaye d’en prescrire le minimum et je milite pour que l’on pose systématiquement des sites d’injection rapide sur les cathéters périphériques pour faciliter/encourager l’ablation de la perfusion. Les raccords de faible volume type « pieuvre » facilite bien la réhabilitation je trouve.
Les anesthésistes sont souvent obsédés par la diurèse. A juste titre puisque c’est probablement le meilleur marqueur d’adéquation entre le transport et la consommation de l’oxygène de l’organisme. Mais je trouve dommage qu’on s’entête à obtenir 2 litres d’urine par jour quitte à saturer le patient d’eau et de sel. Il y a quand même de plus en plus de littérature rapportant un effet néfaste de l’oedème viscéral. Cet oedème que l’on ne voit pas est péjoratif pour la reprise du transit par exemple (sempiternel combat du micro vs macro mais c’est une autre histoire). J’essaye donc de prendre plus de recul vis à vis de la diurèse quotidienne et je diminue aussi ma prescription de consignes du style « si diurèse < 100 cc/3h : RINGER LACTATE 500 ml en débit libre » qui faisait pourtant parti de mes prescriptions favorites.
Ensuite, je ne connais pas de justification à l’administration de vitamines ou d’oligoéléments dans les solutions glucosées post-op. Ces flacons ont un coût d’environ 10 euros. Soit on nourrit, soit on ne nourrit pas, apporter juste des vitamines n’a pas de sens chez un patient en post-opératoire sans défaillance. Même raisonnement avec la glutamine : on ne l’administre pas seule sans apports d’acides aminés (i.e. dans le cadre d’une nutrition parentérale totale)
Toujours à propos des vitamines, lorsque l’on réhydrate un patient (alcoolique) sévèrement dénutri (hospitalisation en urgence par exemple) il y a un risque de déficit en thiamine. Il faut alors lui apporter 500 mg de vitamine B1 pour prévenir l’encéphalopathie de Gayet-Wernicke (1 g ça n’apporte rien de plus, c’est une légende urbaine). Cette situation n’est quand même pas très courante dans les services de chirurgie où les patients bénéficie d’un suivi nutritionnel et je pense que l’on administre trop de cocktails de B1/B6 à des doses immenses sans justification. Pour moi ce sont les benzodiazépines comme le diazepam et l’oxazepam qui préviennent le mieux le risque de delirium tremens chez les alcooliques. Les vitamines n’ont pas de rôle dans la prévention du DT.
J’évite de coller des tas de choses dans les perfusions comme le nefopam (pharmaco peu adaptée) ou le phloroglucinol (j’y crois moyen-moyen). Je n’y mets pas non plus de benzodiazépines.
Enfin, à part le cas particulier d’un patient déjà en nutrition parentérale totale avant l’intervention il n’y a peu pas de justification à se précipiter à faire du support nutritionnel parentéral en post-opératoire.
P.S. on peut aussi redoubler de vigilance quant aux cathéters laissés sur le patient, j’aime bien qu’on perfuse d’un seul côté, quitte à mettre la PCA et l’hydratation du même côté pour laisser un bras *complètement* libre au patient. (< Merci à Nico qui se reconnaîtra)
UPDATE : bon résumé chez la Perruche sur le sujet de la perfusion en général
Réflexion sur le réveil en fin d’intervention
Ce mois ci un édito d’Anesthesiology ouvre une réflexion sur la ventilation des patients endormis bénéficiant d’une ventilation mécanique.
Cet article permet de s’interroger sur les modalités optimales de ventilation mécanique d’un patient aux poumons sains (sujet dont la pertinence équivaut à peu près à de la sodomie de diptère en vol dans 98% des cas) et sur les modalités de réveil. L’auteur se pose un peu en visionnaire. Après une courte explication de texte sur le réveil des patients, il propose de laisser les patients en hypercapnie légère durant les interventions. Les arguments sont plus que minces et non évalués scientifiquement, mais l’auteur a envie de remettre en question les pratiques alors il se lâche ! je me demande sincèrement comment ce genre d’édito passe dans de grandes revues internationales comme ça… S’il suffit de pondre une idée et d’écrire trois lignes invitant la terre entière à changer de pratique, je commence demain.
Peu importe, ça me donne une excuse pour causer du réveil en anesthésie
En pratique le réveil est un moment que je trouve un peu mal codifié dans la pratique anesthésique. Le principe global marche toujours : on arrête le produit-qui-fait-faire-dodo et quelques minutes plus tard le patient se réveille. Ce dogme est souvent saupoudré de recettes magiques pour que le patient reprenne une ventilation spontanée… Il y a une pratique courante que je ne comprends pas tout à fait : c’est le réveil façon Jacques Mayol… Je m’explique, on apprend dans les blocs à laisser monter un peu la capnie en fin d’intervention pour que « l’hypercapnie stimule la reprise de la ventilation ». Bon, bon, c’est vrai que le pH du liquide cérébro-spinal est un facteur influençant les centres respiratoires, mais malheureusement cette pratique dérive souvent vers un extrême néfaste : la ventilation mécanique est coupée, le patient est placé sur un circuit où il peut respirer librement et on attend. Malheureusement la suite du scénario est moins réjouissante : apnée, PaCO2 qui grimpe probablement au dessus de 60 mmHg (avec son cortège d’effets indésirables), et halogénés qui stagnent dans le cerveau. Bof bof.
L’écueil inverse est facile à comprendre. Les gaz halogénés qui maintiennent les patients endormis s’éliminent majoritairement par voie pulmonaire. En augmentant la ventilation-minute du patient, on augmente l’élimination des halogénés. Victoire ? Bof, en hyperventilant le patient, il y a de grandes chances que l’hypocapnie induite favorise une vasoconstriction cérébrale, donc une diminution du débit cérébral gênant l’élimination des drogues. Quadrature du cercle ?
Probablement que la voie du milieu est encore une fois la meilleure solution. A mon sens il est intéressant de diminuer un peu la ventilation-minute en fin d’intervention pour « laisser monter » l’EtCO2 aux environs de 40. Mais cette pratique doit s’accompagner d’une bonne anticipation de l’arrêt des gaz anesthésiques, d’une grande vigilance quant aux réadministrations d’opiacés en fin d’intervention et de l’antagonisation des curares.
Sur l’arrêt des gaz, on sait aujourd’hui qu’un patient retrouve un état d’éveil rapide grâce à des produits comme le desflurane. Rapide ne veut quand même pas dire immédiat. Faites des essais, chronométrez, vous avez quand même 10 minutes devant vous ! A vous de jauger par votre pratique combien de temps met l’opérateur à terminer ses pansements.
A propos des opiacés, j’ai déjà rapporté dans ses colonnes les propos fort intéressants d’anesthésistes cherchant avec insistance des alternatives aux opiacés générateurs de trop d’effets indésirables. Je comprends cette crainte dans les équipes d’anesthésie que le patient se réveille avec de la douleur. Ca serait pour nous un échec complet qu’un patient se torde de douleur en salle de réveil (SSPI). Ainsi on voit fréquemment dans les blocs des réadministrations d’opiacés en fin d’intervention… « une petite louche de suf pour la route… il n’aura pas mal comme ça »… malheureusement je pense que cette pratique peut être délétère. En effet, je pense tout d’abord qu’il est assez rare qu’un patient arrive en SSPI en se tordant de douleurs, il existe quelques cas particuliers, mais ça n’est franchement pas la majorité. Il faut tout de même quelques heures pour que la réaction inflammatoire se développe et que la douleur soit gênante pour le patient. Le vécu du patient sera mieux évaluable et plus pertinent dans les heures qui suivent l’intervention. A mon sens c’est donc plutôt l’analgésie de la première nuit post-op et des premières mobilisations sur laquelle il faut se concentrer. En plus en administrant des morphiniques en fin d’intervention sans avoir d’évaluation du ressenti du patient on l’expose probablement à des effets indésirables comme des nausées ou plus grave des pauses respiratoires.
Enfin, je ne sais pas quoi penser de l’hétérogénéité des pratiques concernant la gestion des curares dans les blocs opératoires. Ils font partis des médicaments les plus dangereux maniés dans les blocs opératoires mais l’habitude semble affaiblir la vigilance nécessaire. Pourquoi ? Je n’en sais rien. Aujourd’hui je ne comprends pas que l’on n’utilise pas systématiquement les drogues qui sont à notre disposition pour contrer l’effet des curares. Je pense que c’est une vraie sécurité pour les patients d’utiliser ces produits mais les acteurs ne semblent pas convaincus dans les blocs… culture latine ? lassitudes face aux effets de mode ? La réflexion est ouverte, moi j’ai choisi mon camp.
Ils sont forts ces belges ! (morphine : evil !)
Dans les blocs opératoires, on utilise tous les jours des drogues hyperpuissantes sans savoir ce que l’on fait, c’est LE drame de l’anesthésie. On se rassure en constatant rapidement un résultat. On met un hypnotique, le patient dort ; on administre un curare : le patient ne bouge plus. Le sujet délicat c’est la gestion de la douleur. Je mets dans les veines de mes patients des morphiniques mais clairement je ne sais pas ce que je fais. C’est inquiétant non ?
Durant mon premier semestre, j’étais perdu. Comme tout le monde, j’ai acheté un ou deux bouquins. On ne connait rien à cette spécialité mystérieuse avant de la pratiquer. Jamais pendant les études de médecine on nous explique l’anesthésie. Dans les manuels, je lis des posologies, et en pratique je vois mes seniors rigoler quand je leur demande la dose qu’il faut mettre : « qsp dodo ! » qu’ils me répondent. Bon, je ne vais pas aller loin avec ça… j’étais désemparé de constater que la pratique anesthésique était à mille lieux d’une discipline que j’aime beaucoup également : l’infectiologie. En matière de traitement anti-infectieux il y une posologie et une durée de traitement à respecter. Point-barre. En anesthésie, c’est l’anarchie.
L’autre truc que je ne comprenais jamais c’était la gestion des réadministrations des morphiniques et cette phrase : « pfiou qu’est-ce qu’il consomme celui là ! » aka « plus t’en mets plus faut en mettre ». Je ne comprenais pas. Aujourd’hui je comprends à peine plus. Les morphiniques sont des drogues hyper compliquées à gérer. Tellement que certains services d’anesthésie belges les utilisent de moins en moins ! (Finalement ce sont nos vieux patrons de chirurgie qui luttaient contre les administrations de morphine en post-op qui avaient raison ! )
Aujourd’hui je me bagarre dans les blocs pour montrer que toutes les réactions du patient ne sont pas de la douleur, il faut serrer les dents et résister à l’angoisse de mal lutter contre la douleur du patient. Difficile. Le patient a des réflexes, depuis des dizaines d’années on enseigne qu’il faut supprimer ces réflexes avec des morphiniques car ce sont des traductions cliniques de douleur. En fait on en sait rien. Il est super fréquent de constater que les réactions hémodynamiques s’estompent d’elles-mêmes sans rien faire. Auparavant on administrait 10 gammas de suf et on pensait que la résolution de la tachycardie était liée à un contrôle de la douleur… c’est l’histoire du Mucomyst qui guérit la bronchite qui guérit toute seule…
Dans notre région nous avons la chance de côtoyer beaucoup de médecins anesthésistes belges au fil de notre formation. Leur parcours est beaucoup plus axé sur l’anesthésiologie, et moins sur la réanimation. J’ai l’impression qu’ils vont plus au fond de leur discipline. Certains patrons belges ont une expertise très forte. C’est le cas de Marc De Kock à propos des morphiniques. Allez l’écouter, c’est passionnant.
http://www.centreaudiovisuel.be/emc/emc/Podcast_interuniversitaires/Podcast_interuniversitaires.html
Des diurétiques…
Les diurétiques font partie des médicaments que je trouve les plus difficiles à prescrire dans un secteur de réanimation ou de soins intensifs. Ceci est tout simplement lié au fait que la volémie d’un patient fait probablement partie des paramètres les plus difficiles à évaluer. La clinique couplée aux examens complémentaires devraient nous aider mais j’ai l’impression que c’est plutôt l’histoire du patient qui est le plus décisionnel dans ma prescription.
Il existe des situations caricaturales d’hypovolémie qui amène le patient dans les secteurs de soins aigus, le schéma thérapeutique est simple. De même, lorsque l’insuffisance cardiaque prédomine le tableau, il faut savoir soulager la calèche avant de fouetter ! Cette arrière pensée de l’hypovolémie devient plus difficile à gérer quand l’évolution du patient est médiocre, que les journées avec un bilan hydrosodée négatif (hyperperméabilité capillaire) passent et qu’il s’inflate avec persistance d’une oligurie et la fonction rénale en chute libre. Là, l’apprentissage selon l’école de la Réanimation Médicale nous enseigne presque comme un dogme qu’il ne faut absolument pas prescrire de diurétiques. Je suis complètement d’accord avec cette idée, j’ai été éduqué comme ça, et dans les situations inflammatoires où le secteur interstitiel gonfle à vue d’oeil, j’ai peur de faire pire que mieux avec des diurétiques. En effet, l’oedème tissulaire même s’il est délétère a beaucoup moins de conséquence que l’accentuation d’une hypovolémie. Ainsi je continue de croire que la genèse artificielle d’une diurèse participe à l’anxiolyse du docteur et à la dégradation de l’état du patient. Je retiens donc que chez un patient agressé, intubé/ventilé, pour lequel la situation n’est pas réglée le furosémide est à garder dans la poche.
La situation devient tout à fait différente, et les néphrologues nous guident dans ce sens, lorsque le patient sort de son agression aiguë. Lorsque le patient retrouve une diurèse, peu à peu efficace, tout en ayant accumulé de l’eau et du sel dans les jours/semaines précédentes, je comprends mieux l’utilisation de diurétiques de l’anse à fortes doses.
Par contre, là où le casse tête est à son paroxysme pour moi ce sont les situations post-opératoires de chirurgie lourde, notamment la chirurgie thoracique ou digestive.
On a face à nous un patient vasculaire, qui vient de bénéficier par exemple d’une oesophagectomie pour un cancer, qui se dégrade globalement en post-opératoire : majoration de l’encombrement bronchique, dyspnée, oligurie. Par expérience nous observons que les patients souffrent essentiellement de leur insuffisance respiratoire, c’est ça qui les précipite en réanimation. On a alors tendance à jouer des cartes très empiriques en plus des recherches des complications classiques : souffrance de la zone opératoire, embolie pulmonaire, sepsis, etc. Bien souvent on se retrouve dans une situation batarde sans argument franc pour une complication classique, on met alors tout sur le dos de l’ischémie/reperfusion peropératoire et de l’inflammation. Nous utilisons alors de façon complètement empirique des diurétiques en espérant diminuer la surcharge du secteur interstitiel pulmonaire. Fait-on n’importe quoi ? Nous essayons de nous faire guider par l’échographie cardiaque quand nous savons ou quand les cardiologues sont disponibles pour nous aider mais cet examen a lui aussi ses limites. Bref c’est difficile. La situation évolue encore quand malheureusement ce type de patient est admis en réanimation en SDRA, avec des poumons lourds d’oedème et un coeur droit qui se dilate dans un contexte d’hypoxémie et d’HTAP. Je m’interroge sur le retentissement en amont de l’augmentation importante des pressions veineuses et sur la perfusion rénale : les diurétiques ont-ils là encore une place à trouver ?
Focus sur le paracétamol
Ca faisait longtemps que je voulais me faire une petite mise au point sur le paracétamol. En anesthésie nous prescrivons quotidiennement ce médicament pour lutter contre la douleur post-opératoire. On connait mal les voies d’action du paracétamol mais on nous enseigne l’analgésie multi-modale : en ciblant des voies de la douleur différentes des voies bloquées par les morphiniques on optimiserait la prise en charge des patients. Quid ?Back to basics. Le paracétamol, comment ça fonctionne ?
La biodisponibilité du paracétamol est variable mais globalement bonne par voie orale, beaucoup plus variable et imprévisible par voie rectale. L’utilisation de comprimés effervescents et la voie IV améliore la rapidité d’action. En 20 minutes une diminution de la douleur peut être ressentie vs 45 minutes pour des comprimés classiques.
Une fois biodisponible, que fait le paracétamol ? les données sont multiples, reflétant nos connaissances en neurophysiologie… Le paracétamol peut agir au niveau central en diminuant la capacité des COX à produire des prostaglandines. Cet effet n’existe pas en périphérie où le stress oxydant lié à la lésion maintient les COX actives. Le paracétamol a une action de modulation positive des opioïdes endogènes à l’interface entre le cerveau et la moelle (renforcement d’une voie supraspinale vers la moelle). Ensuite le paracétamol interagit avec les voies sérotoninergiques descendantes en renforçant leur action. On trouve des interactions avec des systèmes complexes de métabolisme du NO et des cannabinoïdes endogènes. (On a craint des interactions avec les antiémétiques comme l’ondansétron, mais l’un ne semble pas gommer les effets de l’autre)
Le paracétamol est essentiellement éliminé par le foie où il est métabolisé à 90% par glucurono- et sulpho-conjugaison avec élimination urinaire des métabolites. Approximativement 10% du paracétamol est oxydé par la voie du cytochrome 2E1 qui aboutit à du NAPQI, métabolite oxydant rapidement contrecarré par le glutathion. Lors d’un surdosage en paracétamol, la production exacerbée de NAPQI est responsable de la toxicité hépatique. Un pourcentage quasiment négligeable du paracétamol est éliminé sous forme inchangé dans les urines.
Le paracétamol est un médicament qui a basé son succès sur son efficacité et sa sécurité d’emploi. Le paracétamol diminue la douleur contre placebo, ouf. Le nombre de patient à traiter avec 1g de paracétamol pour diminuer la douleur de 50% est d’environ 3,8 (NNT) : bon médicament ! Ensuite le paracétamol se révèle à l’usage être d’une excellente sécurité d’emploi pour peu que le patient soit éduqué en automédication et que le médecin prescripteur fasse preuve d’un minimum de vigilance : pas plus d’1g toutes les six heures.
Le paracétamol est sûr à l’usage, même dans des population difficiles : les patients âgés peuvent recevoir 3g par jour sans difficultés, les femmes enceintes et allaitantes n’exposent pas leur enfant à un risque particulier, les insuffisants rénaux ne craignent rien en limitant la dose à 3g/jour. Les patients souffrant de pathologies hépatiques bénignes peuvent utiliser de façon sûre le paracétamol. Les alcooliques qui constituent une population à risque de surdosage (insuffisance hépatique potentielle, augmentation du CYP 2E1) peuvent l’utiliser également (lorsque l’on a écarté les situations de dégradation de la fonction hépatique). Les interactions médicamenteuses sont très limitées (un peu de vigilance avec les AVK tout de même, comme avec tout médicament associé aux AVK). Bref la panacée !
Nous l’utilisons donc largement. Mais je m’interroge quant au service rendu au patient dans le contexte de la chirurgie lourde qui nécessitera de toute façon l’administration de morphine via une PCA ? et quel coût engendré : produit, lignes de perfusion, temps à manipuler les lignes…
Belle coïncidence, le BJA sort ce mois ci Paracetamol and selective and non-selective non-steroidal anti-inflammatory drugs for the reduction in morphine-related side-effects after major surgery: a systematic review. Maund E, McDaid C, Rice S, Wright K, Jenkins B, Woolacott N. Br J Anaesth. 2011 Mar;106(3):292-7. La méthodologie de l’étude est nouvelle à mes yeux, il s’agit d’une MCT : mixed treatment comparison. En gros les auteurs essayent de comparer via des études différentes des médicaments qui n’ont pas été comparés entre eux. On peut tout de suite s’interroger sur le niveau de preuves de ce type d’études… à rapprocher des méta-analyses…
Toujours est-il que l’on y apprend que le paracétamol diminue certes de 20% la consommation de morphine mais que ceci n’évite pas les effets indésirables de la morphine, déception non ? Cette étude ne permet pas d’évaluer l’amélioration de l’analgésie fournie en administrant du paracétamol ou des AINS en sus de la PCA morphine. Ceci dit je me pose de plus en plus la question de la nécessité de la multiplication des analgésiques que l’on administre ensemble sans trop savoir ce que donne le cocktail, le multimodal pourquoi pas mais non à la myriade d’antalgiques sans comprendre…
Pistes pour la réflexion et l’action :
Proposer le paracétamol en fonction d’un protocole d’évaluation de la douleur et éduquer les équipes quant à la possibilité de ne pas utiliser systématiquement le paracétamol injectable pour diminuer les coûts (1 euro 50 le flacon chez nous) et les manipulations des lignes de perfusions (surtout les voies centrales)
Passer per os le plus vite possible +++
Anticiper l’analgésie et l’hyperalgésie en pré et perop
Simplifier les prescriptions d’analgésiques post-opératoires, remettre au goût du jour des protocoles simples communs ?
Anticiper, proposer et utiliser plus de techniques d’analgésie loco-régionale
Intravenous Acetaminophen Does Not Reduce Inpatient Opioid P... : Anesthesia & Analgesia [Internet]. [cited 2018 Nov 6]. Available from:
Ong CKS, Seymour RA, Lirk P, Merry AF. Combining paracetamol (acetaminophen) with nonsteroidal antiinflammatory drugs: a qualitative systematic review of analgesic efficacy for acute postoperative pain. Anesth Analg [Internet]. 2010 Apr 1 [cited 2012 Sep 18];110(4):1170–9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20142348
Bannwarth B, Péhourcq F. Pharmacologic basis for using paracetamol: pharmacokinetic and pharmacodynamic issues. Drugs [Internet]. 2003 [cited 2012 Sep 18];63 Spec No 2:5–13. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14758786
Mattia A, Coluzzi F. What anesthesiologists should know about paracetamol (acetaminophen). Minerva Anestesiol [Internet]. 2009 Nov [cited 2012 Sep 18];75(11):644–53. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19881460
Maund E, McDaid C, Rice S, Wright K, Jenkins B, Woolacott N. Paracetamol and selective and non-selective non-steroidal anti-inflammatory drugs for the reduction in morphine-related side-effects after major surgery: a systematic review. Br J Anaesth [Internet]. 2011 Mar [cited 2012 Sep 18];106(3):292–7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21285082
Rumack BH. Acetaminophen misconceptions. Hepatology [Internet]. 2004 Jul [cited 2012 Sep 18];40(1):10–5. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15239079
Kaba A, Joris J. Prise en charge multimodale de la chirurgie abdominale majeure. La réhabilitation post-op\’eratoire [Internet]. 2004 [cited 2012 Sep 18]; Available from: http://www.jepu.net/pdf/2004-05-07.pdf
Dart RC KE. Alcohol and acetaminophen hepatotoxicity. Archives of Internal Medicine [Internet]. 2003 Jan 27;163(2):244–5. Available from: http://dx.doi.org/10.1001/archinte.163.2.244-c
L’équation du mouvement
Lorsque j’ai débuté ma carrière d’étudiant hospitalier j’étais passionné de néphrologie. Les troubles hydro-électrolytiques me fascinaient et j’étais impatient de passer dans un stage où je serai confronter à des hypokaliémies tordues.
En DCEM 3, j’ai eu la chance d’aller en stage dans l’excellente réanimation de l’Hôpital de Tourcoing, j’ai trouvé dans cet hôpital mes Maîtres en Médecine. Durant ce stage, j’ai compris que la réflexion livresque n’était plus valable devant ces patients atteints de pathologies aiguës.
J’ai alors découvert la ventilation mécanique. Et là waaahou, comment font ces docteurs pour faire mieux respirer un patient en tripotant des boutons… D’autant plus impressionnant qu’à l’époque de vieux Puritan Bennet trônaient dans les chambres.
Pour bien comprendre ce que l’on fait en ventilation mécanique il faut retourner un peu vers la physiologie et surtout se focaliser sur des choses simples et fuire les modes mixtes, biscornus et trompeurs. Lorsque l’on est interne en anesthésie-réanimation, il me parait très important de se focaliser sur la compréhension de deux modes : un mode en débit : la VAC et un mode en pression : la VS-AI.
La VAC. On entend souvent Ventilation Assistée Contrôlée. Ces mots côte à côte ne veulent pas dire grand chose, non ? En fait à l’origine VC signifie plutôt Volume Controlled. Il s’agit d’un mode où le médecin impose un volume insufflé dans le patient et les pressions pulmonaires dépendent de la physiologie du patient. Il faut bien comprendre que les machines ne savent pas mesurer directement des volumes. Les machines ont des capteurs de débit, elle mesure et contrôle un débit. En intégrant le débit par le temps, les machines déduisent un volume.
Le A de VAC correspond bien à « assisté ». Ce terme signifie que si le patient est capable de faire un effort inspiratoire, la machine peut détecter ceci grâce au trigger (= déclencheur) et elle souffle ensuite dans le patient un cycle selon les paramètres de débit et de temps que l’on a réglés.
On a donc une machine qui va souffler un débit constant dans le patient, ce qui va générer une pression positive dans les voies aériennes, cette pression sera variable en fonction des paramètres physiologiques du patient (résistance et compliance) et de vos réglages.
L’équation du mouvement décrit ceci.
Paw = P0 + Pres + Pel
où Paw est la pression dans les voies aériennes, P0 la pression de départ, Pres les pressions liées au résistances des voies aériennes et Pel les pressions liées à la compliance du système.
P0 c’est la PEP totale, elle dépend de la PEP intrinsèque (l’air piégé dans/par le patient) et de la PEP extrinsèque (la PEP que vous réglez sur le ventilateur)
Pres dépend des résistances et du débit, Pres = Q x R (souvenez vous de la loi d’Ohm : U = RI)
Pel dépend de la compliance et du volume courant que vous souhaitez.
En intégrant cette équation dans votre réflexion vous serez plus à même de comprendre et d’optimiser vos réglages, et si vous travaillez régulièrement avec un débit élevé (1L/s / 60 l/min) vous pourrez en un clin d’oeil avoir une idée de la compliance et des résistances des voies aériennes. Un argument de plus pour l’utilisation d’un haut débit : la diminution du travail respiratoire lorsque le patient déclenche lui même le cycle.